2024年医药行业报告:拐点来临与投资策略
行业拐点将至,布局创新弹性及业绩确定性方向
行业拐点将至,布局创新弹性及业绩确定性方向
数据统览:2023年医药板块整体收入增速0.81%、归母净利润增速-20.12%,2024Q1医药板块整体收入增速0.28%、归母净利润增速-0.38%,行业经营拐点将至。提质增效:医药行业在销售、管理、财务和研发方面的费用率同比下降或增长幅度放缓,年度毛利率整体保持稳定,净利率从2019年的6.1%提高到2024Q1的9.6%,扣非归母净利率近稳步提升,显示出医药企业在降低成本、提高运营效率等方面持续取得成效,龙头企业持续逐步从规模扩张阶段过渡到提质增效阶段,盈利能力持续提升。逐步复苏,医药板块有望迎来经营拐点:由于2022年行业基数高及2023年下半年医疗反腐,2023年及2024Q1收入增速慢。我们认为,随着疫情、医疗反腐等因素逐步出清,2024年医药板块的增速有望前低后高,医药板块有望再次回到稳健增长的轨道上,板块经营拐点将至。同时,随着院内诊疗逐步从反腐中恢复,医药板块的景气度环比有望提升。
分板块看:化学制药及生物制品:化学制药2024Q1表现较好,集采影响逐步减弱,创新品种快速放量驱动行业快速增长。中药:2023年板块增速较高,引领板块;2024Q1在高基数下,整体稳健。当前位置,我们建议精选经营改善,能够穿越疫情周期的公司。医疗器械:2024年逐步从疫情中走出,我们看好下半年板块性的大机会,重点推荐家用医疗器械、高值耗材(集采出清方向)、低值耗材(库存周期处于尾声)、体外诊断(国产替代+出海)及医疗设备(设备更新升级)。医药商业:零售药店板块行业集中度持续提升,流通板块增长确定性高,医药商业整体业务稳定。CXO及科研服务:2023年整体承压,但结构性机会仍在;2024年海外有望逐步恢复,但地缘政治给行业带来不确定性;国内基本见底,静待恢复。医疗服务:2023年业绩稳健增长,净利率水平拐点向上。受经济环境及竞争格局变化的影响,行业估值水平持续下行,行业市盈率处于历史底部区域,建议关注长期空间比较大、短期受影响的领域。
子板块涨跌幅看,2024Q1均有一定幅度的下跌。中药及医药商业增长确定性高,估值较低并符合市场风格,在第一季度表现相对较好;医疗服务(包含CXO),由于头部公司受到美国议员提案打压的事件的影响,带动板块回调较多;化学制药、医疗器械及生物制品由于行业性的事件,也有不同程度的回调。
个股方面,尽管医药板块整体表现较弱,但各细分赛道牛股频出:化学制药及生物制品:兴齐眼药新品种获批上市,艾力斯的伏美替尼商业化持续兑现,艾迪药业的HIV新药商业化开启;医疗器械:受益于呼吸道检测的英诺特;医疗服务:多肽产业链持续高景气的诺泰生物;中药板块:板块性表现强势,羚锐制药、佐力药业、东阿阿胶领涨;医药商业:板块性表现强势,国药股份、国药一致等国药系领涨。
1.22024年下半年:板块拐点将至,重点布局创新驱动的高弹性及业绩高确定性
目前板块和细分板块估值仍处于历史低分位水平,医药企业正在从医疗反腐、疫情、地缘政治等影响逐步恢复中;结合国家对创新药、中药、医疗设备更新升级、基药目录调整等利好政策鼓励,当前板块拐点将至,中长期布局时机已至。2024年下半年,我们重点推荐医药创新带来的业绩高弹性及经营稳健业绩确定性增长的细分方向:(1)医药创新带来的高弹性:政策端暖风频吹,国内创新药已实现了从“鼓励大规模创新”到“鼓励高质量创新”的跨越,国内企业研发实力不断提升,供给端持续实现创新升级,项目管线价值也已得到全球市场的认可,制药板块已经迎来靠创新品种驱动业绩高增长的新阶段;(2)经营稳健带来的业绩高确定性:集采逐步出清且竞争格局好的仿制药企业、经营改善的中药企业、医药商业、血制品等细分领域业绩增长的确定性高,经营稳健。
制药及生物制品:创新驱动行业发展,迎接制药板块商业化新周期
药品本质上一种特殊的商品。不同于传统的商品,药品的购买方是患者,药品的选择权(处方)在医生,支付方是医保局/商业保险公司,供给端来自制药企业。现阶段,供应端正发生积极变化,创新品种不断出现;老龄化加速的趋势下,需求端持续增长;医改持续深化,医生处方更加理性;医保局在保基本的前提下,支持医药创新,多元化的支付体系持续完善。仿制药(存量)受集采影响逐渐减弱,市场趋于稳定:2018年以来,9批10轮集中带量采购已纳入423个品种,距国家规划2025年完成500个品种的集采,大品种多数已纳入。第九批国采的采购周期长达4年,标期的延长原则上更加利好中标企业,也更利于稳定市场供应,稳定市场预期,行业竞争格局更加稳定。创新药(增量)陆续获批上市,迎接制药新周期:供给端,国内创新药品种迭出,并陆续进入商业化阶段。支付端,2023年7月28日,上海市印发《上海市进一步完善多元支付机制支持创新药械发展的若干措施》的通知,多元化支付体系持续完善。同时,广东省、河北省、北京市陆续发布文件,做好医保药品单独支付保障工作,在支付端为企业提供便利。我们认为,随着创新药商业化的推进,企业可以快速回收现金,进而促进后续的在研管线的开发,逐步进入良性发展阶段,持续贡献增量业绩。推荐思路:(1)关注Biotech自身商业化,兑现后弹性较大;(2)Biotech与Pharma的合作日趋频繁,关注双方的增量;(3)集采影响基本出清,新品种即将放量的标的;(4)多款国产创新药获得FDA获批上市,国产创新药出海正当时。推荐标的推荐标的:九典制药、智翔金泰、康诺亚、恩华药业、神州细胞、丽珠集团、健康元、人福医药、东诚药业、恒瑞医药、华东医药等。
2.1创新药增量:美联储将进入降息周期,创新药标的估值有望逐步修复
2024年5月2日,美联储宣布将基准利率维持在5.25%-5.50%区间不变,符合市场预期。现阶段通胀环比和非农就业数据超预期程度阶段性放缓,导致美联储无论对加息还是降息都更加谨慎。目前美国基准利率仍处于高位,随着美联储将进入降息周期,流动性改善有助于优化投融资环境并提高新药研发景气度,有望给估值仍处于底部的创新药标的带来更大的估值修复空间。
2024年多地落地全链条支持创新药政策,鼓励创新药高质量发展。2024年以来,多地支持医药创新政策密集出台,包括从现金资助、加速临床试验开展/审评/审批节奏、鼓励多元支付、医保谈判获得政策倾斜以及鼓励投融资等多方面予以支持,全方位促进创新药高质量发展。在多重利好政策下,国产创新药从“与国际接轨”到“出海”也在逐步实现。
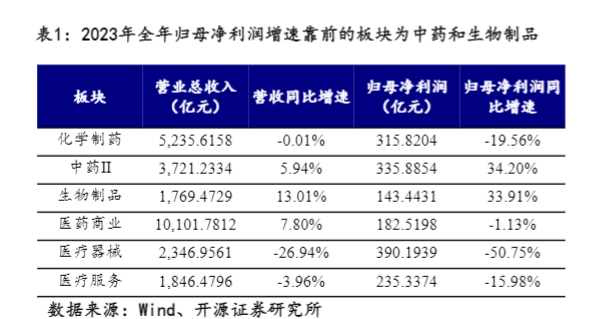
随着审批速度的加快和注册申请数量的增多,创新药迎来密集收获期。在新药审批政策的支持下,近5年我国创新药上市申请审批速度明显加快,2012年我国创新药递交NDA到获批上市的时间平均为927天,而2022年已经缩短至485天。此外,近几年NMPA受理国产1类新药注册申请数量稳步增长,2023年NMPA已受理临床申请2270件,上市申请133件;同时,国内企业对外授权的创新药项目持续增加,预计随着创新药的临床进度快速推进和对外授权的推进,我国创新药上市数量即将迎来快速增长阶段,相关创新药企业可以快速回收现金,进而有望促进后续的在研管线的开发,逐步进入良性发展阶段。
医保谈判平均价格降幅逐步趋于稳定。从医保谈判品种数量和整体平均降幅上看,谈判药物数量稳步提升,药价平均降幅基本处于50-60%区间内,已经逐步趋于稳定。新药从获批上市到进入目录、到入院的时间也在逐渐缩短。政策逐步提升高质量创新药的定价自由度。2024年2月,国家医保局发布《关于建立新上市化学药品首发价格形成机制鼓励高质量创新的通知》征求意见稿,有助于鼓励真正创新药物形成合理的市场价格机制,缩短药品进入终端市场的周期。北京2024年4月7号发布的意见征求意见稿中也明确表示,国谈药目录公布后一个月内召开药事会,全年药事会召开不少于4次。医保谈判变化趋势显示出医保对创新药的支持,鼓励了创新药的研发和市场准入,有助于创新药的快速发展和普及。
近期多个地区发布文件在支付端鼓励生物医药企业创新发展,打通商业化“最后一公里”。2023年7月,上海市印发《上海市进一步完善多元支付机制支持创新药械发展的若干措施》的通知,建立完善多元支付机制,将更多优质的创新药械纳入基本医保和商业健康保险支付范围,提升创新药械的可及性和可负担性,进一步在支付端鼓励生物医药企业创新发展。同时,广东省、河北省、北京市等多个省市陆续发布文件,做好医保药品单独支付保障工作,在支付端进一步为企业提供便利,进一步打通创新药械的支付全流程,商业化环境逐步向好。
创新药行业已进入商业化阶段,关注出海、国内放量及经营质量提升的标的。随着多家企业的创新药产品陆续到达密集兑现期,目前已有多个企业的核心品种已处于快速放量或即将放量阶段,企业的盈利能力也将得到持续改善。其中和黄医药的呋喹替尼已于2023年11月获FDA批准上市,有望凭借疗效优势快速抢占海外市场;康方生物的AK104和AK112有望凭借双抗的疗效优势快速占领市场;荣昌生物、科伦博泰以及迈威生物的核心ADC药物均在全球领先,未来潜力较大。复宏汉霖通过生物类似药和创新药双轮驱动,公司2023年营收与盈利情况均实现显著改善,首次实现年度盈利;和黄医药凭借多款已上市创新药物在全球市场的快速放量,且在2023年收到武田制药合作首付款,公司2023年首次实现盈利。
仿制药存量:集采影响边际减弱,仿制药行业迎接新拐点
集采影响边际减弱,仿制药行业迎接新拐点。国家规划2025年完成500个品种的集采,2018年以来1-9批带量采购已纳入423个品种,大品种多数纳入集采;存量品种数量有限,一致性评价高峰已过,2019年存量品种一致性评价申请受理数量为363个,随后2020-2022年分别为341、334、307个,呈下滑趋势,剩余品种多销售体量较小、一致性评价难度较大。第9批国采来看,通过一致性评价企业数量达5家者才会被纳入,入围门槛提高,集采影响边际减少。
第九批集采周期最长,有助于稳定市场格局。第九批国采执行至2027年12月31日,采购周期长达4年,为历次国采标期之最。标期的延长原则上更加利好中标企业,标期延长至4年有助于提高企业参与投标的积极性、增加中标吸引力,也更利于稳定市场供应,稳定市场预期,行业竞争格局更加稳定。
集采药品占据各疾病领域比例较大,过评品种数向头部企业集中。随着国采推进,各疾病领域用药逐渐被集采药品占据,其中糖尿病、血脂调节2个领域国采药品金额占比已超60%。考虑创新药、独家品种基本无集采风险,预计存量市场后续受集采影响的频率、程度放缓,主要利空因素影响逐步减弱。过评品种数正在不断向少数大型企业聚焦,截至2024年5月,累计过评药品数最多的分别是科伦药业(113个)、齐鲁制药(100个)、复星医药(96个)、石药集团(84个)、上海医药(78个)、正大制药(78个)以及扬子江药业(73个)。集采药品市场集中度提高、规模效应有望逐渐体现,利好头部企业。
药物集采前后销售情况发生变化较大,创新药持续放量。在高血压领域,以沙坦类药物为例,4+7和第一批代量采购厄贝沙坦、厄贝沙坦氢氯噻嗪被纳入,创新独家品种阿利沙坦(ARB,信立泰)持续放量。据PDB数据,阿利沙坦由2017年451万元增长至2022年1.93亿元;在消化领域,拉唑类药物陆续集采,独家品种艾普拉唑(PPI,丽珠集团)、伏诺拉生(PCAB,武田制药)持续保持快速放量。
方向1:关注Biotech自身商业化,兑现后弹性较大
关注Biotech自身商业化,兑现后弹性较大。近年来,有较多biotech公司的药品陆续获批上市,并有较多公司选择自身商业化推广,例如艾力斯的伏美替尼、荣昌生物的维迪西妥单抗等。我们认为,从业绩节奏上看,biotech公司没有存量的业务影响,商业化兑现后业绩弹性较大,但相应公司商业化能力需要持续验证。艾力斯、荣昌生物、泽璟制药、盟科药业、艾迪药业、上海谊众等有望受益。
方向2:Biotech与Pharma的合作日趋频繁,关注双方的增量Biotech与Pharma的合作日趋频繁,关注双方的增量。随着新药的不断获批上市,药企的商业化能力愈发受到重视。对于传统制药企业,已经建立了完善的商业化能力,而biotech的商业化相对欠缺。多数biotech选择与Pharma在商业化阶段进行合作,加速药品商业化进程,例如中国生物制药和亿帆医药、康方生物;济川药业与天境生物、征祥医药;华东医药与英派药业、科济药业等合作。我们认为,对于商业化能力相对欠缺的biotech公司,选择与Pharma合作有望加速药物商业化兑现,并持续进行后续在研管线的开发;对于Pharma,有望凭借在现有销售渠道,快速推进药物入院销售,同时对自身业绩带来增量,提升运营效率。中国生物制药、济川药业、华东医药、亿帆医药、康方生物、泽璟制药等有望受益。
方向3:关注集采影响基本出清,新品种即将放量的标的关注集采影响基本出清,新品种即将上市/放量的标的。从企业的经营角度,多数传统制药公司均在布局吸入制剂、微球及缓控释等竞争壁垒较高的新品种,抑或向创新转型,布局创新药。目前,健康元的的妥布霉素吸入溶液、恩华药业的奥赛利定注射液、九典制药的酮洛芬凝胶贴膏、亿帆医药的亿立舒、海思科的环泊酚注射液均已获批上市;另外,京新药业的地达西尼、科伦药业的A166等已申报上市,一品红的AR882已进入临床三期。我们认为,随着新获批上市及已获批的药品上市,相关公司有望迎来第二增长点。H股的瀚森制药、中国生物制药、三生制药等均类似。
多款国产创新药获得FDA批准上市,国产创新药出海正当时。目前,国内已有多款新药获FDA上市批准上市,包括百济神州的泽布替尼、传奇生物的西达基奥仑赛、君实生物的特瑞普利单抗、和黄医药的呋喹替尼、以及亿帆医药的艾贝格司亭α等5款创新药以及托珠单抗和贝伐珠单抗等生物类似药。此外,百济神州的替雷利珠单抗和恒瑞医药的“双艾”疗法(卡瑞利珠单抗+阿帕替尼)和多款生物类似药在FDA上市审评阶段,有望未来在美国获批上市。百济神州、君实生物、和黄医药、百奥泰、恒瑞医药、亿帆医药等有望受益。
中药:把握创新中药、国企改革、品牌OTC赛道投资机会
中药创新药:政策持续优化,中药新药注册流程有望加快
近年来中医药利好政策频发,2021年国家陆续发布多项重要政策支持中医药行业发展,涉及医保、中药研发创新、中药饮片质量规范管理、中医医疗服务体系建设等各个方面。2022年3月,国务院发布《“十四五”中医药发展规划》,全面支持中医药产业发展。2023年2月28日,国务院发布《中医药振兴发展重大工程实施方案》,统筹部署包括中医药传承创新和现代化工程在内的8项重点工程,确立到2025年实现中医药科技创新能力显著提高、中药质量不断提升等建设目标。2023年2月10日,国家药监局发布《中药注册管理专门规定》(下称“专门规定”),自2023年7月1日起施行。《专门规定》是在2008年原国家食药监局发布的《中药注册管理补充规定》基础上,充分吸纳药品审评审批制度改革成熟经验,结合疫情防控中药成果转化实践探索,借鉴国内外药品监管科学研究成果,全方位、系统地构建了中药注册管理体系,进一步对中药研制相关要求进行细化,加强了中药新药研制与注册管理,在规范化注册的基础上优化了注册流程,有望加快中药注册审批进度。
国内药企对中药新药研发热情持续升温。据米内网统计,2023年国内共有23款中药新药提交上市申请,创下近5年来新高。中药新药获批临床方面,2023年共有58个中药新药获得临床试验默示许可,较2022年的36个增加了22个。58个中药新药中,1类中药创新药有42个、2类中药改良型新药有16个。其中,康缘药业有6款新药获批临床,盈科瑞有5款新药获批临床,以岭药业有3款新药获批临床,苏中药业、广东凯仲生物、新奇康药业等均有2款新药获批临床。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)