2024医药行业报告:MNC大药企研发看点预告三
再生元 – 期待Eylea 8mg长效品种带来二次增长
DUPIXENT(dupilumab,IL-4Rα)
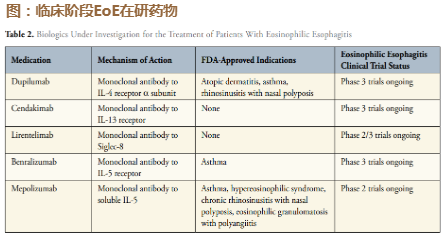
预计2023年中向FDA提交12岁以下儿童嗜酸性食管炎(EoE)适应症上市申请。该品种成人适应症已于2022/5/20在美获批,是 FDA批准的第一款从根源治疗EoE的药物。此前最常见的是氟替卡松以及off-label布地奈德这一类免疫抑制药物以及质子泵抑制 剂(PPI)抑制酸性物质分泌的药物。目前在研品种还包括靶向IL-5的mepolizumab、reslizumab、benralizumab,因为导致 EoE的主要原因是IL-5、IL-4、IL-13的释放。靶向TSLP的Tezepelumab于2021/10/8拿到FDA的孤儿药资格。目前EoE在美国的 发病率为1/2000,即全美大约17.5万患者。
CSU审批PDUFA日期为2023/10/27。目前治疗荨麻 疹的主流用药为抗组胺剂,但有一部分患者无法得到 良好的控制。奥马珠单抗是唯一的靶向生物药。该品 种有望成为第二个CSU的靶向生物药。诺华的口服药 BTK抑制剂remibrutinib已在临床3期阶段(NCT05795153),预计2023H2读出初步分析数据,并有望于2024年提交上市申请。
再生元 – 期待Eylea 8mg长效品种带来二次增长
PRALUENT(alirocumab,PCSK9):预计2023年中向FDA提交HeFH儿童适应症。
Odronextamab(CD20xCD3):预计2023H2向FDA提交B-Cell NHL适应症的上市申请。下图为目前CD20双抗临床数据对比。
再生元 – 期待Eylea 8mg长效品种带来二次增长
Linvoseltamab(BCMAxCD3):
预计2023H2向FDA提交 R/R MM适应症。
EYLEA(aflibercept,PGF/VEGF-A)
图:BCMA双抗临床数据对比
8mg长效剂型PDUFA日期为2023/6/27:此前罗氏的长效双抗品种 Vabysmo上市,对Eylea造成了不小的打击,2023Q1收入下滑6%。预 计Eylea 8mg长效剂型上市后销售额有望重新恢复增长。
2023Q3:PHOTON (DME) and PULSAR (wAMD) 的2年数据
再生元 – 期待Eylea 8mg长效品种带来二次增长
Pozelimab(Anti-C5)
罕见病CHAPLE适应症美国PDUFA日期为2023年8月20日。CHAPLE病(也称为CD55缺乏伴补体过度激活、血管性血栓形成和蛋
白丢失性肠病或CD55缺乏蛋白丢失性肠病)是一种罕见的遗传性免疫疾病,由CD55基因突变导致补体系统过度激活引起。这种疾
病通常始于婴儿期,其特征是腹痛、血性腹泻、呕吐、营养不良、生长缓慢、水肿、反复感染和血凝块。如果获得批准,
pozelimab将成为CHAPLE患者的第一个也是唯一的治疗方法。
Fianlimab + Libtayo(LAG3+PD-1)
2023H2:预计perioperative melanoma 3期试验启动
2023H2:预计perioperative NSCLC 2期试验启动
Vertex – 顺利转型中,年底催化剂集中爆发
Vanzacaftor/tezacaftor/deutivacaftor(CFTR,新一代3药复方制剂)
预计2023年完成12岁以上囊性纤维化(CF)患者的3期试验。
临床2期研究显示其疗效有明显提升,此前的体外试验显示该品种较 Trikafta对于氯离子的传输有更好的效果。对于患者来说,该品种将 ivacaftor进行了氘修饰,改善PK后每日只需口服一次,提升了边界性。
该品种所需要支付的royalty相较Trikafta更低,有望进一步提升公司 净利率。
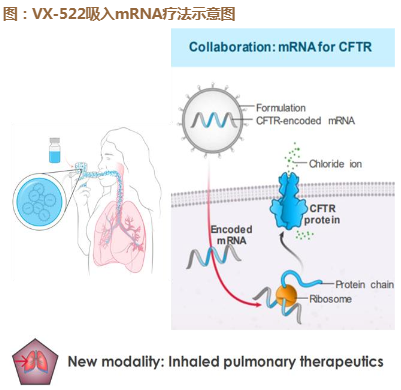
VX-522(CFTR,mRNA疗法)
2023:预计完成CF适应症的SAD(single ascending dose)试验并 启动MAD(multiple ascending dose)试验。
目前全球大约5000名患者无法用小分子口服药治疗,需要mRNA或基 因疗法。
该品种与Moderna联合开发,利用新型LNP肺部吸入(气溶胶)递送 模式确保高效、局部递送和表达。
Vertex – 顺利转型中,年底催化剂集中爆发
Exa-cel(镰状细胞病SCD,输血依赖型beta地中海贫血TDT基因编辑疗法)
由于该申请包括优先审评资格,一旦被采纳,FDA则需要从申请提交算起8个月 之内回复审批意见。这意味着该品种有望于年内获批。
参考Bluebird的竞品Zynteglo(beti-cel)在美国280万美元/次的治疗费用, 我们认为exa-cel凭其更优的疗效和安全性,定价或接近300万美元/次。
由于该类血液病体外基因编辑疗法需要配合强化疗清髓,因此不少患者因无法 承受化疗副作用而无法接受治疗。2023Q1公司宣布与Immunogen合作,联合 开发可替代化疗的ADC以降低副作用,从而exa-cel的适用范围。
VX-548(Nav1.8)
预计2023年底~2024年初完成中度至重度急性疼痛适应症3期试验。
数据来源:Vertex官网,德邦研究所
Nav1.8不表达于中枢神经系统CNS,因此可以免去很多常见阵痛麻醉药带来的副作用,包括长期使用带来的成瘾性等。因此该品 种在慢性疼痛领域有望对阿片类药物进行一定的替代。
Vertex – 顺利转型中,年底催化剂集中爆发
VX-880(一型糖尿病干细胞疗法)
预计2023年启动1型糖尿病Part C。
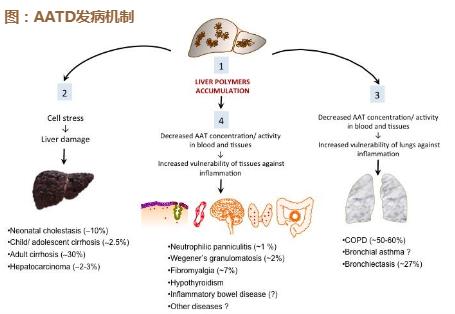
AATD α -1抗胰蛋白酶缺乏症Alpha-1 Antitrypsin Deficiency项目
AATD是一种蛋白酶缺乏的遗传性罕见病,主要影响肝、肺功
能,可能引发COPD或肝硬化。由于目前没有针对病因开发的
药物(DMT),同时也缺乏针对肝脏症状的药物(大部分上市
药物主要针对肺部针状)。
VX-864:预计2023年内完成临床2期入组。该研究时长为48周。
主要观察肝脏堆积AAT清除效果,以及血液中AAT含量,均为
biomarker数据。2022/10/11公司已经公布阶段性数据:28天
Z-polymer清除率高达90%。
VX-634:预计2023年内完成FIH试验。两款品种同为AAT corrector小分子口服药,但由于VX-864药物性质“Drug-like- property”还有待提升,因此该品种仅作为POC工具。在此基础上公司开发了VX-634,不管是药效还是其他成药性都远高于 VX-864。
GSK – 在抗感染领域多维度发展
Jemperli(dostarlimab-gxly,PD-1)
预计2023H2 1L 子宫内膜癌RUBY研究在美国获批。RUBY研究 显示该品种对于dMMR–MSI-H患者,dostarlimab vs. dostarlimab+SOC化疗的24m PFS% HR=0.28,OS HR=0.3。总体PFS HR=0.64,24m OS% HR=0.64。就历史数据来看,SOC化疗的mOS只有3年,而从右图来看,3年期dostarlimab 组OS%基本上还在60%以上。在第一个中期分析节点时,总患 者群体(不分dMMR–MSI-H)两组的差距 HR=0.64,但还没 有达到终止临床的“显著性”标准,因此试验还需继续。
参考Keytruda说明书,目前K药也有两个子宫内膜癌适应症:1)联合仑伐替尼治疗化疗进展后的pMMR患者,2)单药治疗s MSI-H or/dMMR患者。
GSK – 在抗感染领域多维度发展
Bepirovirsen:
预计乙肝B-Together(联合干扰素)临床2b期数据2023H2读出。
该品种为Ionis开发的ASO疗法。
2022/11/24公司曾公布过B-clear(单药,无干扰素)研究数据。
该品种已于2022年底进入临床3期,共两项研究:B-Well 1 和 B-Well 2。两 项研究均为单药试验。预计2025年初步完结。
从竞争格局来看,RNAi疗法中Bepirovirsen进度最快,其余目前均在2期阶段。
GSK – 在抗感染领域多维度发展
AREXVY(RSV疫苗):2023/5/4 FDA批准用于预防60岁及以上人群由呼吸道合胞病毒(RSV)引起的下呼吸道疾病(LRTD)
Blenrep(belantamab mafodotin-blmf,BCMA ADC)
2023H2:预计2L+ multiple myeloma(DREAMM-7)3期数据读出,并提交上市申请。
2023H2:预计2L+ multiple myeloma(DREAMM-8)3期数据读出,并提交上市申请。
Momelotininb(ACVR1 / ALK2, JAK1, JAK2 ):2023/6/16骨髓纤维化 PDUFA date。
Zejula(Niraparib,PARP1/2):预计1L 卵巢癌维持疗法(FIRST)3期数据2023H2读出。
gepotidacin(Top II,新型抗生素)
2023H2:预计泌尿生殖淋病(EAGLE-1)3期数据读出。
2023H2:预计无并发症的尿路感染(EAGLE-2/3)适应症在欧洲提交。
Biogen – Leqembi预计上市5年销售额18亿
结论:虽然公司已经度过最艰难的时期,但前路依旧不算太明朗。Leqembi市场接受度如何重点要看7/6日CMS最终支付决定。于此同时,Zuranolone上市可能会给公司带来一定的转机。 图:2023Q1 FDA批准上市的药物
LEQEMBI(lecanemab,APP beta Amyloid)
FDA将于6/9日Adcom会议讨论是否批准 Leqembi的“常规BLA上市申请”。
FDA将会在7/6(PDUFA)给出最终审批结果。
该品种于2023/1/6日通过加速审批通道(AA),基于临床2期以及临床3期topline数 据获批上市。目前依然在AA状态下。
由于此前第一款上市的A-beta抗体药物Aducanumab疗效饱受争议,CMS只愿为:1)继续参与临床以证实药物疗效的患者,2)获得完全获批“full approval”A-beta抗体药物支付治疗费用。因此目前为止,aducanumab和lecanemab都没有得到大范围的 医保支持,二者售价均在2.5万美元/年以上,所以目前业绩惨淡。这也是为什么7/6日的最终审批结果至关重要,届时CMS的支付 态度也将变得明朗。
根据Nature文章《FDA new drug approvals in Q1 2023》,该品种2028年预期销售额约18.7亿美元。
zuranolone(GABAA):FDA将于8/5做出对该品种重度抑郁症MDD和产后抑郁症PPD最终审批决定。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)