2024医药行业报告:MNC大药企研发看点预告
强生(JNJ) – 继续强化血液瘤布局
结论:今年公司在肿瘤领域关注度较高,一方面多维度提升血液瘤品种的多元化,另一方面在肺癌领域或带来新的突破。
Aprocitentan(ETRa/b):难治性高血压 TRHTN 预计年内在美国获批。
该品种由Idorsia研发,是首款将ETRa/b抑制剂运用于高血压的药物。 公司已于2022年12月在美国提交NDA。
美国约2000万耐药性高血压患者。
Talquetamab(GPRC5D/CD3双抗):复发难治性多发性骨髓瘤 R/R MM 预计年内在美国和欧洲获批。
2022年底基于临床1/2期MonumenTAL-1多发性骨髓瘤RRMM研究数据提交上市申请。一旦获批,将会成为公司第5款MM产品。 最新研究数据显示:中位5L且3重耐药的患者ORR达到73.1%~74.1%,mFU接近15个月,mDOR大于9个月。
公司对于MM领域新药布局:根据公司官网数据:MonumenTAL-1和MajesTEC-1的数据(同为中位5L患者),Talquetamab 14.9m随访ORR为74%,而Teclistamab 14.1m随访ORR为63%。非头对头数据显示Talquetamab似乎更胜一筹。
根据医药魔方数据,目前全球仅罗氏一家竞争对手正在开发同靶点药物forimtamig,目前在临床1期。2022年ASH会议上公布临床 数据显示:静脉注射ORR达到71.4%,皮下ORR为63.6%。
值得一提的是,在5/12日,阿斯利康从礼新医药以5500万美元首付款获得了一款GPRC5D ADC的全球权益,该品种目前在临床前 阶段,进度上落后于强生的双抗。
强生(JNJ) – 继续强化血液瘤布局
CARVYKTI(Ciltacabtagene autoleucel,BCMA CAR-T)
CARTITUDE-4数据读出,并在年内于美国和欧洲提交上市申请。
原本计划于今年在EHA大会上公布的CARTITUDE-4数据提前泄露:数据显示CARVYKTI较标准疗法可降低74%的复发风险,即 HR=0.26,疗效显著甚至超出了行业一致性预期。相比之下,竞争对手BMS和2Seventy的Abecma的HR为0.49,虽然显著优于标 准疗法,但不及CARVYKTI数据惊艳。
RYBREVANT (Amivantamab,EGFR x cMET 双抗):
化疗联用治疗前线NSCLC的临床3期PAPILLON数据读出。
Lazertinib联用对照Tagrisso治疗1L NSCLC的临床3期MARIPOSA研究预计提早至今年年底读出。公司在2023Q1业绩会上表示,进度提前主要因患者接纳度非常高以至于入组进度比较快,因此试验有望提前结束。若该研究最终数据显示amivantamab组合疗法 显著优于Tagrisso,则有望重写目前非小细胞肺癌的治疗指南。
目前该品种仅通过加速审批通道ORR数据获批三线疗法,对应美国患者数量约2200人,mPFS和mOS分别为8.3和22.8个月,对应 年费用接近20万美元。
强生和Halozyme合作,利用Halozyme的ENHANZE技术开发皮下注射制剂,目前已经初步完结,预计2025~2027年上市。 晚期胃癌、食管癌临床2期GIC2001研究数据读出。
强生(JNJ) – 继续强化血液瘤布局
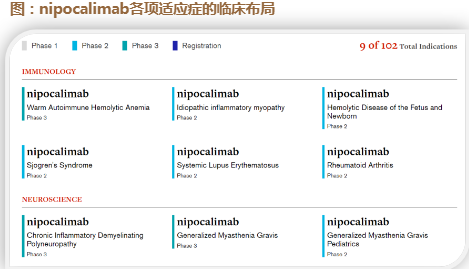
Darzalex(Daratumumab,CD38):不可接受骨髓移植的多发性骨髓瘤临床3期SYMPATICO研究数据读出。 Nipocalimab(FcRn IgG1抗体):
该品种由AnaptysBio开发,后转让给Momenta Pharmaceutica,专攻罕见免疫炎症。2020年Momenta被强生以65亿美元收购。 目前有9个适应症在临床中后期阶段,其中慢性脱髓鞘性神经炎(CIDP)、重症肌无力(MG),以及抗体型自身免疫性溶血性贫血
(wAIHA)在临床3期。
公司于2023/2/6公布该品种新生儿溶血病(HDFN)临床2期POC研究达到主要终点:32周孕期内不需要 IUT输血。该数据属于早期TOPLINE结果。根据
American Journal of Obstetrics and Gynecology:美国HDFN发病率约80/10万孕妇。强生于2023年3 月表示:目前nipocalimab是唯一一款进入临床用于 治疗同种免疫导致的HDFN的品种。
近年来,越来越多Biotech研发聚焦一些相对罕见的 免疫炎症。
礼来(LLY) – 集齐减肥、抗衰老、抗炎3大百亿产品线
结论:今年到明年初主要看点为4大重磅品种的获批,包括Tirzepatide减重适应症,Donanemab阿尔兹海默症,Mirikizumab肠炎,Lebrikizumab皮炎。以上品种预计会带动公司从2024年起进入业绩快速成长期。
Tirzepatide(GIP/GLP-1R):
慢性体重管理(减重)适应症在美国提交上市申请,有望于2023年内获批。 启动与Semaglutide 2.4mg 头对头减重研究。
SURMOUNT-3:联合生活习惯改变(运动+饮食)高强度减重研究数据读出。 SURMOUNT-4:长期维持减重研究数据读出。
Donanemab(A-beta):阿尔兹海默症在美国提交上市申请。
临床3期数据显示:用药组接近一半的患者用药后12个月内没有恶化/进展;18个月进展的速度比安慰剂组慢35%(iADRS)或36% (CDR-SB)。相比之下,Lencanemab在CLARITY研究中较安慰剂减缓27%(CDR-SB)。
安全性数据显示:有症状的ARIA-E/H分别为6.1%和13.6%,高于Lecanemba,在这方面Lecanemab似乎更优。
直观来看,donanemab的疗效似乎优于lecanemab。其实不然,donanemab的研究将患者以大脑tau蛋白沉积水平分层。中度沉 积患者进展延缓达到36%。这个数字与Lecanemab的27%非常接近。
综合以上非头对头疗效以及安全性的数据来看,且基于现阶段有限的topline数据,似乎并无法得出donanemab的结论。
礼来(LLY) – 集齐减肥、抗衰老、抗炎3大百亿产品线
Retatrutide(LY3437943,GIP/GCC/GLP-1R):
预计于2023年内启动临床3期减重研究。
临床1期数据:剂量范围0.1~6mg,6mg组BMI为29.4,平均体重
82.1kg,第8天减重4.13%,且单剂可维持体重长达43天。
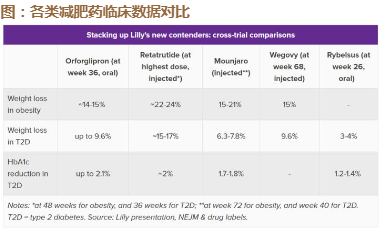
临床2期非糖尿病患者减重研究显示:对于BMI>30的肥胖患者,该品 种48周可达到22%-24%的减重效果(剂量不明),非头对头数据优于 tirzepatide,临床3期72周减重22.5%。
右图为当前市场关注度较高的几款减重品种非头对头数据对比。
Orforglipron(GLP-1R小分子):进3期
全球首个启动临床3期减重、糖尿病研究的小分子GLP-1。
数据来源:Evaluate,德邦研究所
图:Orforglipron临床设计
该临床3期预计2025年初步完结,预计此前会有阶段性数据公布。 之所以领先辉瑞一步是因为danuglipron需要每日口服两次。辉瑞决定 等待一日一次的PF-07081532临床2期数据读出后,再在二者中选其一 进入临床3期。

礼来(LLY) – 集齐减肥、抗衰老、抗炎3大百亿产品线
Remternetug(N3pH-A-beta 抗体):
已经启动临床3期阿尔兹海默症研究,预计2025年初步完结。 该品种为Donanemab的升级版。
临床1期J1G-MC-LAKB (NCT04451408)研究显示该品种有效降低 淀粉样蛋白斑块
Mirikizumab(p19 IL-23 抗体):
溃疡性结肠炎UC在美国上市(因生产问题延期)。 克罗恩病CD临床3期数据读出。
Lebrikizumab(IL-13 抗体):
诺和诺德(NVO) – 减重管线多点开花
Semaglutide(GLP-1 多肽):
2023H2:25/50mg口服糖尿病适应症美国提交上市申请。目前糖尿病semaglutide口服产品Rybelsus最高剂量为14mg/日。 2023Q2:50mg口服药减重临床3期数据读出。目前用于减重的口服semaglutide暂时未获批上市。Evaluate Pharma预测该品 种上市后,2028年口服semaglutide的销售额可达近60亿美元。
2023Q2:STEP HFpEF 心衰临床3期数据读出。
2023H2:STEP HFpEF心衰临床3期糖尿病患者数据读出。
2023年中:SELECT CVOT肥胖患者心血管风险降低临床3期数据读出。其实Semaglutide可有效降低糖尿病患者的心血管发病 风险早在2016年就被证实,相较安慰剂风险降低26%,但因心血管发病导致的死亡率与安慰剂接近。
美国于2008年开始要求所有糖尿病药物都需要做长期的CVOT研究。不管是心衰,还是CVOT,目前的SGLT2和GLP-1类药物获 批的适应症都是从糖尿病领域衍生出来的。而后SGLT2也的确获批用于治疗非糖尿病患者的心衰。截至2022年5月,包括DPP4、SGLT-2、GLP-1类药物在内的已有累计23项CVOT研究。而SELECT是首个跃过糖尿病,直接将肥胖和心血管疾病联系起来的 CVOT研究。因此该类研究数据备受瞩目。
诺和诺德(NVO) – 减重管线多点开花
CagriSema(AmylinR+GLP-1R 多肽复方)
2023H2启动糖尿病临床3期研究。
从临床1期数据来看,CagriSema是目前减重效果最快的品种,4.8mg组20周减重 17.1%。
Amycritin(口服 GLP-1xAmylin双激动剂 多肽):
2023H2临床1期数据读出。
该品种属于CagriSema的升级版,不同与复方制剂的Cagrisema,amycretin是一个多 肽分子。
该品种运用SNAC技术制成口服制剂,患者接纳度更高,可及患者更多。公司多肽SNAC
技术的商业化较市场更为领先。在目前减重新药研发领域里同质化的竞争格局下,有明 显的差异化优势。
诺和诺德(NVO) – 减重管线多点开花
PYY(gut hormone fragment peptide YY 多肽):
2023Q2临床1/2期减重数据读出。
该品种同样也是天然多肽的衍生物,直接作用于中枢神经系统以抑制食欲;肥胖 患者身体中PYY含量较少,可能是导致肥胖的主要机制之一。
竞争对手礼来管线中也拥有同类品种。
Ziltivekimab(IL-6 抗体):
2023Q2临床3期心衰HFpEF研究启动。
炎症和心衰息息相关,2019年一项BIOSTAT-CHF研究表明:心衰患者血液中的 IL-6显著高于正常范围。
临床2期biomarker POC数据显示:hsCRP降低程度显著优于安慰剂。
公司近年来一直在心血管领域扩大布局。不仅通过糖尿病、肥胖药物向心衰、 MACE领域拓展,还在心衰领域布局了干细胞疗法,临床1期已于2023Q1启动。
艾伯维(ABBV)-免疫双雄继续拓展适应症
Rinvoq(Upadacitinib,JAK1):
克罗恩病CD适应症即将在美国获批。该适应症已于2023/4/17在欧洲获批。Rinvoq是该适应症目前唯一获批的口服JAK抑制剂, 有助提高患者接受度。在此之前靶向疗法几乎全是生物药,机制包括TNF-a,IL-23等(包括公司自己的Skyrizi)。
白癜风适应症临床2期(NCT04927975)数据读出。目前FDA批准的白癜风靶向药物非常少,仅2022年获批的Opzelura(Ruxolitinib,涂抹型JAK抑制剂)。目前在临床阶段的其他JAK抑制剂包括:Ifidancitinib、Ritlecitinib、Brepocitinib、Cerdulatinib,其中进展最快的是辉瑞的Ritlecitinib,目前在临床3期。
Skyrizi(Risankizumab,IL-23):UC induction/维持临床3期/注册数据读出,并提交上市申请。 Epcoritamab(CD3 x CD20双抗,皮下注射制剂,与Genmab联合开发):
R/R DLBCL快速审批通道上市,PDUFA日期5/21。目前FDA批准的CD20双抗仅罗氏的Lunsumnio(Mosunetuzumab)。此外, 罗氏的2:1双抗glofitamab预计也将于2023年获批,PDUFA日期为7/1。再生元的odronextamab和强生的plamotamab目前都在 临床2期。对于R/R DLBCL,epcoritamab的ORR和CR分别为63%和39%,glofitamab是51.6%和39.4%。Cross-trial对比,疗效 接近,epcoritamab在安全性方面比较有优势,CRS不到50%,而glofitamab则为63%。
3L DLBCL临床3期数据读出。
艾伯维(ABBV)-免疫双雄继续拓展适应症
Venclexta(BCL-2):
3L+ 多发性骨髓瘤提交上市申请。
3L+ T(11;14)多发性骨髓瘤临床3期数据读出。
Navitoclax(BCL-2/BCL-xL):IL骨髓纤维化症MF临床3期数据读出并提交上市申请。
Teliso-V(cMet ADC,授权自Seagen / Pierre Fabre):临床2期 2L+ NSCLC 注册性研究数据读出。
ABBV-951(foscarbidopa + foslevodopa):晚期帕金森获批推迟。
该品种为上市产品DUOPA (carbidopa and levodopa)的升级款,其成分为DUOPA的前药。
不同与DUOPA的肠内给药方式,该品种为24小时持续皮下注射制剂,更为便捷。相较于口服药,可以持续不间断控制疾病。由于 装置需要长时间持续佩戴,且属于有创递送,监管机构对其审核要求也会比较高。
艾伯维(ABBV)-免疫双雄继续拓展适应症
早期品种看点:
ABBV-637(EGFR-BCL-xLi ADC):NSCLC肺癌早期POC数据读出。 TTX-030(CD39):临床1期实体瘤数据读出。
CLBR001/SWI019 (CD19 sCAR-T) 临床1期血液瘤数据读出。
Eftoza (TRAIL) :临床1期血液瘤POC数据读出。
AGN-241622 (Alpha2):临床1期老花眼数据读出。
阿斯利康 – 2030年目标肺癌一半的市场
Beyfortus(Nirsevimab,全球首个预防性RSV中和抗体,由AZ和Sanofi联合开发)
2023H1:基于MEDLOFY/MEDLEY研究在美国获批上市,销售由Sanofi负责。根据Fortune Business Insights,定价预计600美 元/针,而近期GSK刚获批上市的RSV疫苗Arexvy定价在60-185美元/剂。虽然中和抗体缺乏价格优势,但对于无法承受疫苗副作用, 或者自身免疫系统对疫苗不敏感的人群来说,中和抗体的保护效果更为确切。且Arexvy仅获批老年人群体,而Beyfortus则是主攻 新生儿市场。对于Beyfortus来说,最大的竞争对手是辉瑞的RSV疫苗ABRYSVO,针对新生儿/孕妇适应症,该品种将在5/18迎来 AdCom会议。需要注意的是ABRYSVO临床试验中疫苗组早产率为5.3%相当于安慰剂组的两倍,是不可忽视的副作用。
2023H1:中国提交上市申请。该品种预防RSV感染的保护率为80%,目前已在欧洲上市。
Lynparza(Olaparib,PARP,与Merck联合开发)
2023H1:基于PROpel研究,联合abiraterone + prednisone/prednisolone治疗1L前列腺癌在美国获批。4/28 FDA ODAC 会议 结果为支持该适应症获批,但就是否只批给带有BRCA突变的患者投票结果为11赞成,1反对,1票弃权。而公司则是希望BRCA阴 性患者也能获批。该研究的探索性数据显示:BRAC+患者 rPFS HR=0.23,mOS HR=0.29,而BRCA-患者rPFS HR=0.76,mOS HR=0.91,与对照组差别甚微。
2023H2 : 1L子宫内膜癌临床3期DUO-E研究数据读出。
阿斯利康 – 2030年目标肺癌一半的市场
Imfinzi(Durvalumab,PD-L1)
2023H2 : NSCLC新辅助疗法基于AEGEAN研究在美国提交上市申请。 2023H2 :不可切除3期NSCLC临床3期PACIFIC-2研究数据读出。
2023H2 : SCLC临床3期ADRIATIC研究数据读出。
2023H2 :局部性肝癌临床3期EMERALD-1研究数据读出。
2023H2 :膀胱癌NIAGARA和1L膀胱癌NILE两项临床3期研究数据读出,并 提交上市申请。
Tagrisso(Osimertinib,EGFR):
1L EGFR mNSCLC临床3期FLAURA2临床数据读出并于2023H2提交上市申请。
2023H2 : EGFR 3期不可切除NSCLC临床3期LAURA数据读出并提交上市申 请。
2023年中:ADAURA研究最终OS细节数据在ASCO会议上展示。公司已经连 续5年受邀ASCO Plenary。
公司在业绩会上表示2030年目标拿下肺癌一半的市场。
阿斯利康 – 2030年目标肺癌一半的市场
Enhertu(HER2,T-DXd ADC)
2023H2 :2L HER2-Low乳腺癌临床3期DB06研究数据读出。按照HER表达量根据IHC来划分:1)IHC3+=HER2+,属于传统 曲妥珠单抗适应症覆盖范围,占乳腺癌患者的20%;2)IHC1~2+=HER2-low,占比50%,是DB04研究覆盖的范围;3) IHC0~1+=HER2-ultralow,占比15~30%,DB06正好纳入了这部分ultralow的患者。通过DB04的分组数据可以看到IHC1+和 IHC2+的HR非常接近,IHC1+甚至还更小一些。说明HER2的表达量在一定范围内疗效并没有因其下降而减弱T-DXd的疗效。通过 这一点我们似乎可以推断出DB06中IHC0组或许也能做出显著差异。如果能证实这一点,那么Enhertu有望彻底打破HER2表达的限 制,成为真正的乳腺癌王者品种。
2023H2:3L HER2-Low乳腺癌适应症DB04中国获批。
Dato-DXd(TROP2 ADC)
3L NSCLC 临床3期TROPION-Lung01研究数据读出,并有望于2023H2提交上市申请。
2023H2:不可切除/转移性HR+/HER2-乳腺癌临床3期TROPION-Breast01数据读出,并提交上市申请。
Capivasertib(AKT):晚期3阴乳腺癌mTNBC临床3期CAPItello-290研究数据读出。