2024年医药生物行业双周报:医保调整与创新发展分析
1行情回顾
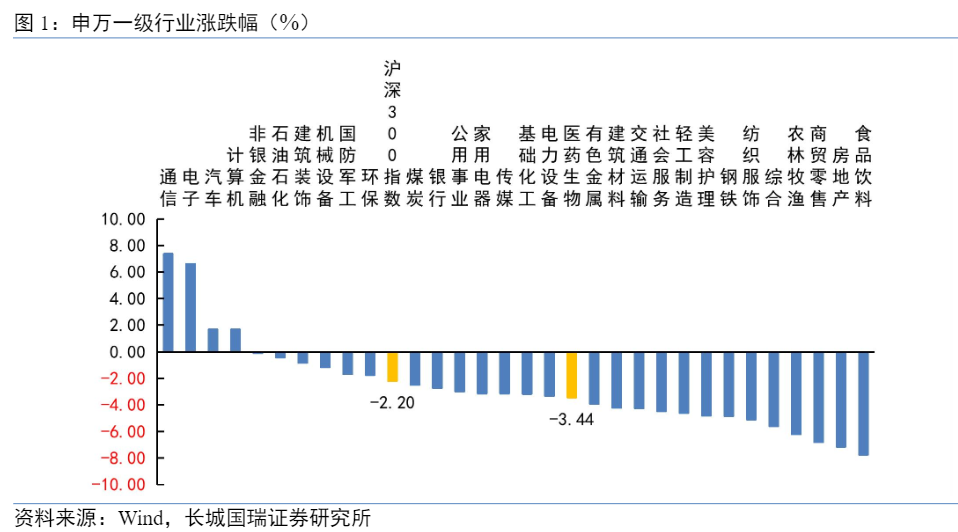
本报告期医药生物行业指数跌幅为3.44%,在申万31个一级行业中位居第18,跑输沪深300指数(-2.20%)。从子行业来看,仅原料药、血液制品上涨,涨幅分别为0.55%、0.29%;线下药店、中药跌幅居前,跌幅分别为17.78%、6.69%。
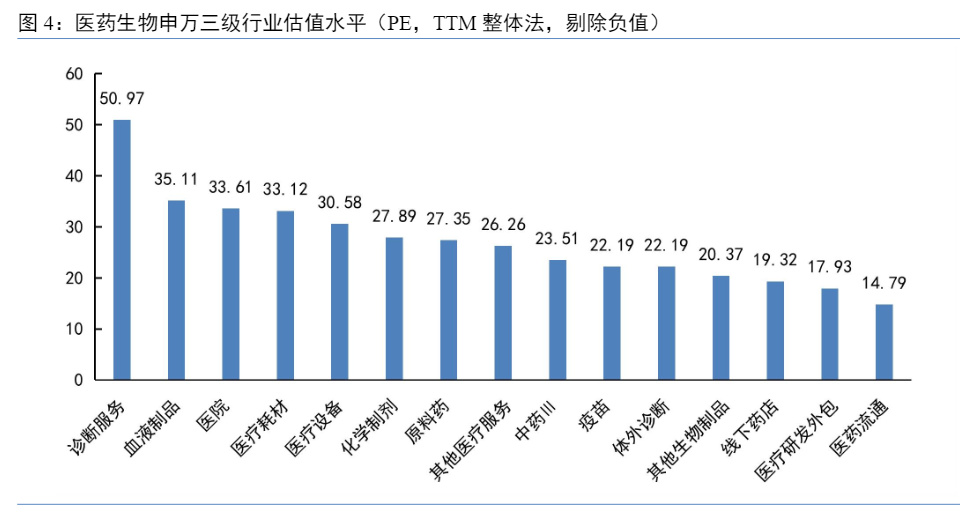
估值方面,截至2024年6月21日,医药生物行业PE(TTM整体法,剔除负值)为24.87x(上期末为25.86x),估值下行,低于负一倍标准差。医药生物申万三级行业PE(TTM整体法,剔除负值)前三的行业分别为诊断服务(50.97x)、血液制品(35.11x)、医院(33.61x),中位数为26.26x,医药流通(14.79x)估值最低。

2行业重要资讯
2.1国家政策
NMPA:《血液制品生产智慧监管三年行动计划(2024—2026年)》为全面加快推进血液制品生产智慧监管工作,督促血液制品生产转型升级,切实保障血液制品安全、有效和质量可控,NMPA研究制定了《血液制品生产智慧监管三年行动计划(2024—2026年)》并于2024年6月11日发布公告印发。《三年行动计划》主要包括工作目标、主要任务、实施步骤和工作要求四部分。工作目标部分,按照率先实施、分批推进的原则,每年指导三分之一的血液制品生产企业完成智慧化建设工作,通过三年行动,基本实现全部血液制品生产企业生产、检验等全过程的信息化管理。主要任务部分,涉及四个方面,包括:加强血浆接收环节信息化管理、加强血液制品生产环节信息化管理、加强血液制品检验环节信息化管理、保障信息化管理系统的合规性与安全性。实施步骤部分,划分三个阶段,分别为:率先实施阶段(2024年6月至12月)、持续推进阶段(2025年1月至12月)、总体完成阶段(2026年1月至12月)。
为全面了解在产血液制品生产企业信息化建设情况,科学合理制定《三年行动计划》,NMPA组织对全部在产血液制品生产企业信息化建设情况进行调研,并分片区召开专题座谈会。结合血液制品生产企业制定的信息化建设工作计划,针对不同企业计划完成时间的差异性,《三年行动计划》在三年内分批推进实施血液制品生产智慧监管工作。
《三年行动计划》印发实施后,NMPA将组织开展宣贯解读和督促指导,并于每年年底通报工作进展,指导省级药品监管部门督促各生产企业加快设施设备升级改造,积极完成血液制品生产智慧监管工作,实现生产、检验环节电子化记录、关键环节的可视化采集,确保血液制品生产智慧监管工作有序推进、按时完成。(资料来源:NMPA网站)
国家卫健委/国家中医药局:《关于支持福建建设海峡两岸融合发展示范区十五项卫生健康措施》为贯彻落实《中共中央国务院关于支持福建探索海峡两岸融合发展新路建设两岸融合发展示范区的意见》,近日,国家卫生健康委、国家中医药局联合印发《关于支持福建建设海峡两岸融合发展示范区十五项卫生健康措施的通知》,从4方面提出15项措施,主要包括:一是加大台湾卫生人才吸引力度。鼓励支持符合条件的台资医院申请住院医师规范化培训基地,向在闽台湾医师开放国家卫生健康突出贡献中青年专家选拔,在闽台胞参加国家医师资格考试,可自主选择符合条件的医院进行工作实践,推动闽台双方中医“双向”师承教育等。二是完善在闽台胞卫生健康制度保障。支持在闽常住台胞享受基本公共卫生服务,推动持台胞证可实现网上预约挂号服务等。三是推动福建省重点区域率先突破。支持在闽台资医院建设互联网医院,支持台湾护理、药学等卫生专业技术人员来闽就业,支持福建建设闽台中药材集散基地、筹建两岸中医药领域专家智库等。四是推动福建省卫生健康事业高质量发展。
指导福建省有关地市参与国家公立医院改革与高质量发展示范项目和国家重大传染病防治基地项目,落实委省合作协议,支持指导福建省全省推广三明医改经验,不断推动深化医改取得新成效等。若干措施将有助于进一步加强闽台医疗卫生交流合作,深化两岸卫生健康领域融合发展。(资料来源:国家卫健委网站)
国家医保局:《2024年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》及相关文件公开征求意见根据《基本医疗保险用药管理暂行办法》等有关文件,结合2024年国家基本医疗保险、工伤保险和生育保险药品目录管理工作重点,国家医保局研究起草了《2024年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案(征求意见稿)》以及《2024年国家基本医疗保险、工伤保险和生育保险药品目录调整申报指南(征求意见稿)》,于2024年6月13日向社会公开征求意见。公众可于2024年6月19日17:00前提出意见和建议,以书面或电子邮件的形式向国家医保局反馈。续约和竞价沿用去年规则,将与定稿后的工作方案及相关文件一并公布。根据《工作方案》,2024年国家药品目录调整分为准备(2024年5-6月)、申报(2024年7-8月、专家评审(2024年8-9月)、谈判/竞价(2024年9-11月)、公布结果(2024年11月)共5个阶段。此外,《工作方案》指出了调出目录重点考虑的情形:(1)近3年未向医保定点医药机构供应的常规目录药品;(2)截至2024年6月30日,未按协议约定保障市场供应的谈判药品;(3)符合《基本医疗保险用药管理暂行办法》第九条、第十条规定的药品。(资料来源:国家医保局网站)
国家卫生健康委/国家医保局/国家疾控局/NMPA:国务院政策例行吹风会,2024年深化医改“划重点”近日,国务院办公厅印发《深化医药卫生体制改革2024年重点工作任务》,进一步细化医改“路线图”。今年医改有哪些新亮点?健康获得感如何再提升?在2024年6月14日举行的国务院政策例行吹风会上,国家卫生健康委、国家医保局、国家疾控局、国家药监局四部门回应关切。一,“三医”同向发力。医疗、医保、医药密不可分,改革时尤需同向发力。促进“三医”协同发展和治理,是当前深化医改的重要内容。“要探索建立医疗、医保、医药统一高效的政策协同、信息联通和监管联动机制。”国家卫生健康委副主任李斌说。据介绍,在政策协同方面,今年医改将创新“三医”协同发展和治理的跨部门工作机制,使各项改革政策目标一致、措施协同,提升整体效能。在信息联通方面,将以检查检验结果互认、费用一站式结算、电子健康档案和电子病历规范查询、远程医疗、异地就医等业务应用场景为重点,把数据共享和业务联动放在更加突出的位置。在监管联动方面,治理医药领域损害群众健康权益的问题,强化部门联动,全链条加强监管,形成“三医”标准统一、相互衔接、相互配合的监管格局,建立健全联合执法、联合惩戒制度。福建省三明市在长期实践中不断深化“三医联动”改革。深入推广三明医改经验,仍是2024年重点工作任务之一。
“将深入总结归纳三明及其他典型地区的好经验、好做法,对全国推广三明等地医改经验进行再部署、再强化、再提升。”李斌说。二,医药集采“降价不降质”。2024年重点工作任务明确,推进药品和医用耗材集中带量采购提质扩面。这意味着,医药集采将进一步扩围,让老百姓持续受益。国家医保局副局长黄华波介绍,今年国家层面至少开展一批药品和一批高值医用耗材集采。药品集采将聚焦通过仿制药质量和疗效一致性评价、竞争较为充分的品种;耗材集采将聚焦临床需要、价格虚高、群众反映较为强烈的品种。“预计到2024年底,各地国家和省级集采药品将累计达到500个。”黄华波说,国家医保局将重点指导地方开展联盟采购,包括湖北牵头开展中成药集采、三明联盟牵头开展肿瘤和呼吸系统疾病用药集采等。加强集采中选药品和医用耗材质量监管,同样也是2024年医药集采的重点工作任务之一。
黄华波介绍,为确保集采中选产品“降价不降质”,国家组织药品集采将通过质量和疗效一致性评价作为仿制药参加集采的门槛。同时,对国家组织集采中选产品出现的质量相关问题,医保部门和药监部门联合开展处置,采取取消中选资格、纳入“违规名单”等惩戒措施。三,医防融合有“新招”。2024年重点工作任务提出,要提高公共卫生服务能力,包括开展传染病防控医防协同、医防融合创新试点,推进医疗机构疾控监督员制度试点,开展探索赋予公共卫生医师处方权试点等。“公共卫生医师在基层医疗卫生机构和专病防治机构的疾病随访管理、综合干预等领域具有专业优势。”国家疾控局副局长沈洪兵介绍,我国已率先在黑龙江、广东等省份启动公共卫生医师处方权试点工作。
沈洪兵表示,严把医疗质量安全关和促进医防协同、防治结合是这一工作的重点。比如,将公共卫生医师处方行为纳入临床质量管理体系,选择整体风险可控的部分传染病、慢性病、地方病等病种开展处方权试点工作等。在公立医院、基层医疗卫生机构和社会办医院设立专兼职疾控监督员,督促落实传染病疫情和突发公共卫生事件报告责任。2023年,我国还在上海、安徽等9个省份先行试点医疗机构疾控监督员制度,将疾控监督工作关口前移。沈洪兵表示,第一阶段试点工作取得积极成效,今年将进一步扩大范围,在全国开展试点。四,让新药好药“加速”惠民。
2022年至今累计批准创新药品82个、创新医疗器械138个,仅今年前五个月已经批准创新药20个、创新医疗器械21个。国家药监局副局长黄果介绍,国家药监局通过健全鼓励创新机制,加速推进临床急需、重大疾病防治等新药的审评审批,并将临床急需的短缺药、儿童用药、罕见病用药、重大传染病用药、疾病防控急需疫苗和创新疫苗等纳入加快审评审批范围。此外,不断接轨国际审评标准。“下一步,将持续推进药品审评审批制度改革,持续优化和完善药品审评审批工作,力争跑出支持新药好药上市的‘加速度’。”黄果说。药品质量直接关系到公众健康和生命安全。据介绍,药品监管部门将持续压实企业的质量安全主体责任,指导企业完善质量管理体系,合规生产经营,并持续强化监督检查、质量抽检、不良反应监测等工作。“对质量问题‘零容忍’,让人民群众能够用上更多更好的放心药品。”黄果说。(资料来源:国家政府网站)
2.2注册上市
兴盟生物:抗狂犬病毒复方抗体制剂获NMPA批准上市,为国内首款2024年6月12日,NMPA官网显示,兴盟生物的泽美洛韦玛佐瑞韦单抗注射液获批上市。这是国内首款获批的抗狂犬病毒复方抗体制剂——单抗鸡尾酒疗法产品MAbCocktailProduct。对于变异性强或者多亚型的病毒感染性疾病,如新冠、狂犬病,鸡尾酒疗法是更优和更安全的治疗手段,可以有效地覆盖突变株免疫的逃逸。泽美洛韦玛佐瑞韦单抗为两株人源化单克隆免疫球蛋白IgG1κ抗体:泽美洛韦单抗和玛佐瑞韦单抗,按照质量比1:1混合制成,通过对狂犬病毒多个糖蛋白位点的特异性结合,有效地实现对狂犬病毒的中和,从而消除狂犬病毒对神经细胞的感染能力。用于成人狂犬病病毒暴露者的被动免疫。
泽美洛韦单抗和玛佐瑞韦单抗对狂犬病毒糖蛋白具有高亲和力。两株单抗的抗原结合位点是特定且非重叠的,位于狂犬病毒糖蛋白序列不连续位置,无相互竞争效应,组合使用具有广谱的针对不同种群狂犬病毒株的中和保护和交叉保护作用。中国III期临床试验显示,所有受试者用药后的保护率为100%(即无狂犬病死亡率),SYN023试验组用药后第8天RVNA(狂犬病毒中和抗体)几何平均滴度远高于HRIG对照组,达到全部主要疗效终点以及安全性终点要求。(资料来源:医药魔方)
君实生物:“特瑞普利单抗”第9项适应症获NMPA批准上市,一线治疗小细胞肺癌2024年6月12日,NMPA网站显示,君实生物的特瑞普利单抗注射液(商品名:拓益)新适应症获批上市,联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗,这是特瑞普利单抗获批的第9项适应症。本次获批上市是主要基于III期EXTENTORCH研究结果。这是一项随机、双盲、安慰剂对照、多中心的III期临床,旨在比较特瑞普利单抗或安慰剂联合依托泊苷及铂类在一线治疗ES-SCLC的有效性和安全性。
该研究在全国启动了51家中心,患者按1:1比例随机分配,接受特瑞普利单抗或安慰剂联合依托泊苷及铂类的治疗,直到出现疾病进展、不可耐受的毒性或方案规定的其他需要终止治疗的情况。结果表明,相比单纯化疗,特瑞普利单抗联合化疗一线治疗ES-SCLC可显著延长患者的无进展生存期(PFS)和总生存期(OS)。在最终PFS分析的数据截止日期(2022年2月28日)时,中位随访时间为11.8个月。与单纯化疗组相比,特瑞普利单抗联合化疗组的PFS显著改善(5.8vs.5.6个月,HR0.667,P=0.0002);且1年PFS率更高(18.1%vs.4.9%),较单纯化疗组提升近4倍。
在数据截止(2023年4月20日)的最终OS分析中,特瑞普利单抗联合化疗组的OS显著改善(14.6vs.13.3个月,HR0.798,P=0.0327)、1年OS率更高(63.1%vs.54.9%)。安全性方面,特瑞普利单抗安全性数据与既往研究相似,未发现新的安全性信号。特瑞普利单抗是我国批准上市的首个国产PD-1单抗,截至目前已在中国获批9项适应症,覆盖黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、肺癌、肾细胞癌。2023年10月,特瑞普利单抗成功在美获批上市,适应症为:(1)联合顺铂/吉西他滨一线治疗转移性或复发性局部晚期鼻咽癌成人患者;(2)单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌成人患者。(资料来源:医药魔方)
正大天晴:1类新药“依奉阿克”获NMPA批准上市,治疗ALK阳性非小细胞肺癌2024年6月17日,正大天晴抗肿瘤1类创新药枸橼酸依奉阿克胶囊(TQ-B3139)获得NMPA批准上市,用于治疗未接受过间变性淋巴瘤激酶(ALK)抑制剂治疗的ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者。依奉阿克是正大天晴和首药控股子公司赛林泰医药共同开发的一款c-Met/ALK/ROS1多靶点酪氨酸激酶抑制剂,双方共同拥有该药的知识产权。其中首药控股负责前期化合物分子的设计和优化,正大天晴负责临床开发。依奉阿克不仅能够抑制NCI-H3122细胞(表达EML4-ALK融合基因)中ALK及其下游AKT和ERK1/2的磷酸化,也能够抑制SNU-5细胞(c-Met高表达)中c-Met及其下游ERK1/2的磷酸化。依奉阿克还能够诱导NCI-H3122细胞周期阻滞在G1期并诱导NCI-H3122细胞凋亡。
III期临床(TQ-B3139-III-01研究)数据显示,相比于克唑替尼,依奉阿克能够显著延长初治ALK阳性NSCLC患者的无进展生存期(24.87vs.11.60个月,p<0.0001),同时能够很好的控制患者脑转移的发生和发展。整体而言,ALK靶点领域稍显拥挤,国内已有10款药物上市,其中6款进口、4款国产。(资料来源:医药魔方)◆圣和药业:“甲磺酸瑞厄替尼片”获NMPA批准上市,用于治疗非小细胞肺癌2024年6月17日,NMPA官网显示,圣和药业甲磺酸瑞厄替尼片获批上市,适应症为既往经EGFR-TKI治疗时或治疗后出现疾病进展并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。甲磺酸瑞厄替尼片(SH-1028片)是圣和药业研发的第三代EGFR-TKI,其可以不可逆地结合于突变形式的EGFR(T790M、L858R和19外显子缺失),抑制EGFR的磷酸化过程,阻断下游信号通路的激活。临床前的体内外研究均表明瑞厄替尼对野生型EGFR激酶具有较高的选择性。
截止目前,国内已有6款三代EGFR-TKI上市,其余5款分别为奥希替尼(阿斯利康)、阿美替尼(豪森药业)、伏美替尼(艾力斯)、贝福替尼(贝达药业)和瑞齐替尼(倍而达)。奥希替尼于2017年3月22日获NMPA批准上市,目前已获批的适应症包括一线治疗、二线治疗和辅助治疗EGFR突变型NSCLC。阿美替尼于2020年3月17日获NMPA批准上市,是首款获批上市的国产三代EGFR-TKI,目前已获批的适应症包括一线治疗和二线治疗EGFR突变型NSCLC。伏美替尼于2021年3月2日获NMPA批准上市,是第三款在国内获批上市的EGFR-TKI,目前已获批的适应症包括一线治疗和二线治疗EGFR突变型NSCLC。贝福替尼于2023年5月29日获NMPA批准上市,目前已获批的适应症包括一线治疗和二线治疗EGFR突变型NSCLC。瑞齐替尼于2024年5月15日获NMPA批准上市,用于二线治疗EGFR突变型NSCLC。除此之外,奥赛康的Limertinib(ASK120067)和强生的兰泽替尼这两款三代EGFR-TKI也已在国内申报上市。(资料来源:医药魔方)
默沙东:K药“帕博利珠单抗”获FDA批准一线治疗子宫内膜癌新适应症,为子宫内膜癌领域首个无视错配修复状态的一线免疫疗法2024年6月17日,默沙东宣布帕博利珠单抗(Keytruda,K药)的补充生物制品许可申请(sBLA)获FDA批准,用于联合标准化疗(卡铂和紫杉醇)治疗原发性晚期或复发性子宫内膜癌患者。这意味着,K药成为子宫内膜癌领域首个无视错配修复状态的一线免疫疗法。这也是K药在子宫内膜癌领域获批的第3项适应症,同时也是其在美国获批的第40项适应症。此次批准主要是基于III期NRG-GY018研究的积极结果。该研究是一项随机、双盲、安慰剂对照临床试验(N=816),评估了K药联合化疗和安慰剂联合化疗治疗错配修复正常(pMMR)型和错配修复缺陷(dMMR)型原发性晚期或复发性子宫内膜癌患者的疗效和安全性。研究的主要终点为无进展生存期(PFS)。
结果显示,无论肿瘤的错配修复状态如何,K药联合化疗组患者的PFS均较安慰剂组显著延长。在588例可评估疗效的pMMR型子宫内膜癌患者中,中位随访7.9个月时,K药联合化疗组和安慰剂联合化疗组患者的中位PFS分别为13.1个月(95%CI:10.5-18.8)和8.7个月(95%CI:8.4-10.7)。相较于安慰剂联合化疗,K药联合化疗可将患者的疾病进展或死亡风险显著降低46%(HR=0.54,95%CI:0.41-0.71,p<0.00001)。在225例可评估疗效的dMMR型子宫内膜癌患者中,中位随访12个月时,K药联合化疗组和安慰剂联合化疗组患者的中位PFS分别为尚未达到(95%CI:30.6-NR)和7.6个月(95%CI:6.4-9.9)。相较于安慰剂联合化疗,K药联合化疗可将患者的疾病进展或死亡风险显著降低70%(HR=0.30,95%CI:0.19-0.48,P<0.00001)。
安全性方面,K药的表现与既往研究一致。在pMMR队列中,K药联合化疗组和安慰剂联合化疗组分别有55.1%和45.3%的患者发生3级以上不良事件(AE);在dMMR队列中,K药联合化疗组和安慰剂联合化疗组分别有63.3%和47.2%的患者发生3级以上AE。此前,K药在子宫内膜癌领域已获批两项适应症:①联合仑伐替尼治疗非微卫星高度不稳定(MSI-H)或pMMR晚期子宫内膜癌患者,这些患者既往接受过系统治疗后疾病进展且不适合进行根治性手术或放疗;②单药治疗MSI-H或dMMR晚期子宫内膜癌患者,这些患者既往接受过系统治疗后疾病进展且不适合进行根治性手术或放疗。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)