2024医药生物行业报告:翰森制药创新驱动增长与国际化战略
1.“Big Pharma”转型不断提速
翰森制药成立于1995年,是中国领先的创新驱动型制药企业,下属豪森药业、常州恒邦药业、翰森生物医药等,致力于通过持续创新改善人类健康与生命质量,重点关注抗肿瘤、抗感染、中枢神经系统类疾病、代谢疾病及自身免疫性疾病等领域。公司早年以仿制药起家,随后由于集采政策,逐步转型为创新药业务,截止至2023年底,翰森制药共有8款创新药成功上市(含合作产品),创新药营收不断提高,创新转型不断加速。公司管理层经验丰富,深耕行业。钟慧娟女士是集团创始人,出任董事会主席、首席执行官兼执行董事等职务,在医药行业拥有近三十年运营和管理经验。吕爱锋先生在制药行业的研发及产品质量控制体系方面拥有超过二十年的技术及管理经验。公司整体高管团队架构稳定,相关经验丰富。

管线布局全面,多年的创新药开发与临床转化,使公司在抗肿瘤、中枢神经系统、抗感染及代谢等领域拥有多项优势产品。其中已上市的产品共有8款(含合作产品),涵盖上述疾病领域,为公司的创新研发打下坚实基本盘。

此外,公司基于雄厚的创新研发平台,围绕已上市的核心品种,对五大优势领域对管线进行纵深升级。目前公司共有超过30个创新药项目正在进行50余项临床试验,覆盖ADC、单抗、双抗及siRNA等前沿领域,形成了多领域梯队化的潜力管线。
两款ADC授权GSK,打开国际化征程市场,并通过交易并购积极扩充自身管线:
1)HS-20089(B7-H4 ADC):2023年10月,公司将HS-20089的全球独家权利(不包括中国大陆、香港、澳门和台湾地区)授权GSK,根据协议,公司将收取8,500万美元首付款并有资格收取最多14.85亿美元的里程碑付款,以及全球净销售额分级支付特许权使用费。
2)HS-20093(B7-H3 ADC):2023年12月,公司与GSK宣布双方已签订关于HS-20093的独家许可。根据协议,葛兰素史克将获得HS-20093的全球独家权利(不包括中国大陆、香港、澳门和台湾地区)推进HS-20093的临床开发和商业化。根据该协议的条款,葛兰素史克将支付1.85亿美元预付款。此外,翰森制药将有资格就HS-20093获得高达15.25亿美元成功里程碑付款。HS-20093商业化后,葛兰素史克将按中国大陆、香港、澳门和台湾地区以外的全球净销售额分级支付特许权使用费。
3)引进优质创新管线:公司与荃信生物、普米斯、SCYNEXIS、VielaBio等公司达成战略合作,先后引进QX004N、HS-20117、艾瑞芬净、伊奈利珠单抗等创新品种,持续扩充管线。
公司营业收入持续稳定增长,2022年受疫情影响小有下滑,随着2023年复苏后整体回暖,公司营收有望回归正增长。2023年利润端增长势头强劲,同比+22.56%。
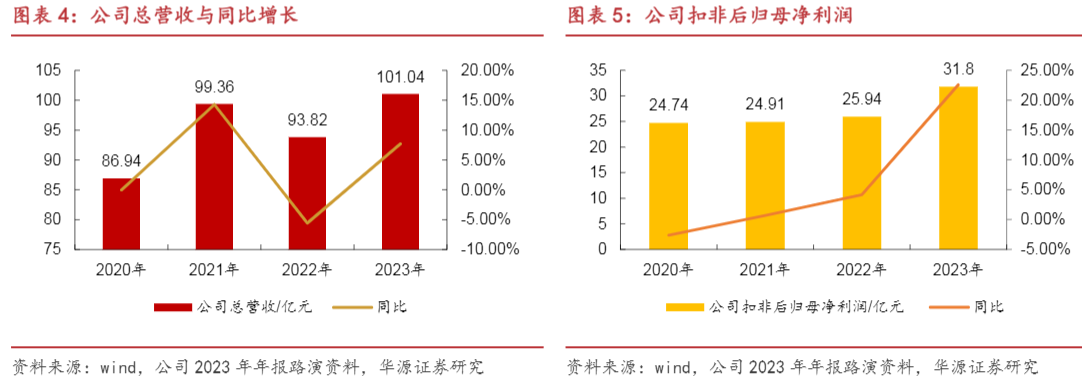
与此同时,公司的创新药业务收入再创新高达68.65亿元,占总营收比例达到67.9%。从历年数据来看,翰森制药创新药业务收入的绝对值和对公司营收的贡献也是一路增高的态势,显示出公司整体业务结构已经发生质的变化。公司2023年在抗肿瘤领域产品组合共计实现收入61.69亿元,总营收占比61.0%,是公司的重要收入来源。中枢神经治疗领域也是翰森制药的优势领域,2023年实现营收13.67亿元,营收占比15.5%。抗感染、代谢及其他同样贡献了可观的收入。
2.肿瘤领域:具备核心优势,稳固市场壁垒
抗肿瘤是公司的核心优势领域,从阿美乐、豪森昕福等明星创新药产品到B7-H3 ADC、B7-H4 ADC等在研优势管线,公司具备全方位多适应症市场潜力,后劲充足,未来可期。
2.1 阿美替尼:肺癌领域领头雁
阿美替尼(商品名:阿美乐)是公司肿瘤领域的头号产品,是中国首个原创三代EGFR-TKI,目前已获批二线治疗EGFR T790M+晚期NSCLC(2020年3月)、一线治疗EGFR+晚期NSCLC(2021年12月)两个适应症,具有明显先发优势。未来随着适应症拓展与医保覆盖,市场潜力广阔。
积极推进4项临床III期研究,主要包括:
术后辅助:甲磺酸阿美替尼对比安慰剂用于表皮生长因子受体敏感突变阳性的II-IIIB期非小细胞肺癌辅助治疗的有效性和安全性:一项随机、对照、双盲、III期、多中心临床研究(CTR20202460)。
靶化联合:甲磺酸阿美替尼或安慰剂联合化疗作为可完全切除的表皮生长因子受体敏感突变的II-IIIB期非小细胞肺癌围手术期治疗的随机、对照、双盲、多中心的III期临床研究(CTR20201857)。
非经典突变:甲磺酸阿美替尼对比含铂双药化疗用于表皮生长因子受体非经典突变的局部晚期或转移性非小细胞肺癌一线治疗的有效性和安全性:一项随机、对照、开放、III期、多中心临床研究(CTR20211262)。三代EGFR-TKI成为目前临床主流用药。中国非小细胞肺癌(NSCLC)患者EGFR基因突变率高,约50.3%的NSCLC患者携带EGFR驱动基因突变。
第一代EGFR-TKI吉非替尼的问世开启了肺癌的精准医疗时代,但EGFRm+晚期NSCLC患者仍面临着疗效、脑转移、安全性等临床亟待解决的问题。一/二代EGFR-TKI穿透血脑屏障的能力有限,超过40%EGFR突变阳性晚期NSCLC患者可出现脑转移。同时,一/二代EGFR-TKI不良反应发生率高。随着医学研究的不断发展,三代EGFR-TKI为EGFR敏感突变晚期NSCLC患者的靶向治疗提供了新的选择。三代EGFR-TKI一线治疗的PFS获益远高于一/二代,三代相较于一/二代EGFR-TKI治疗脑转移患者的中位PFS也显著延长,且不良反应发生率相对较低,因此,将三代EGFR-TKI提升到一线用药可为EGFR突变阳性的晚期NSCLC患者带来更长的生存获益。
阿美替尼是国产首款三代EGFR-TKI,通过改构增强疗效与安全性。从化学结构结构上,阿美替尼创新性地引入环丙基进行结构优化,环丙基结构一方面可增强疗效,使得阿美替尼能够高效抑制EGFR敏感突变和T790M耐药突变;另一方面可降低脱靶效应,使得阿美替尼对WT-EGFR的抑制作用减弱,从而有助减少不良反应;此外,环丙基结构的亲脂性有助阿美替尼更好地透过血脑屏障,高效持久抑制脑转移;环丙基结构还能增加代谢稳定性,阿美替尼的代谢产物单一,有助减少代谢产物相关的不良反应。
阿美替尼多项临床数据都显现出优异的疗效,PFS展现了赶超进口三代TKI奥希替尼的趋势,并且安全性和耐受性更好,副作用更低,对脑转移患者有显著的获益。
出海获批在即,2022年6月,阿美替尼在境外的首个上市许可申请获MHRA受理,用于一线治疗具有EGFR敏感突变的阳性局部晚期或NSCLC及用于治疗既往经EGFR-TKI治疗进展,且T790M突变阳性的局部晚期或转移性NSCLC。2022年12月,阿美替尼用于治疗表皮生长因子突变的NSCLC的上市许可申请也获得了EMA的受理。
2.2 氟马替尼:血液肿瘤新型TKI
氟马替尼(商品名:豪森昕福)是公司自主研发的第二代TKI药物,于2019年11月国内获批上市,用于治疗Ph染色体阳性的CML-CP成人患者,纳入国家医保。相较于其他二代TKI药物,氟马替尼进行结构优化,以提高疗效与安全性。
氟马替尼在伊马替尼分子结构基础上进行了三大优化改造:导入三氟甲基、引入吡啶环代替苯环、保持酰胺键方向,使得本药与变异的BCR-ABL仍然保持较高的亲和力,提高了对ABL的选择性,进一步提高了治疗效果及耐受性。慢性髓性白血病(CML)是一种从骨髓造血细胞开始侵入血液的癌症,属于罕见的恶性血液疾病,占成人白血病的15%。根据NIH数据显示,全球年发病率为1.6/10万~2/10万,美国CML的年发病率约为1.9/10万人,2023年预计有约8930例新发患者。
在20世纪70年代中期,CML5年生存率只有20%,随着BCR-ABL抑制剂陆续获得批准上市,最新数据显示,CML的5年(2013-2019年)生存率达到了70.6%,增加了两倍多,预示着大部分患者存在长期用药需求。中国几个地区的流行病学调查显示国内CML的年发病率为0.39/10万~0.55/10万,中国CML患者较西方更年轻化,中位发病年龄为45~50 岁,西方国家的中位发病年龄为67岁。随着CML病例增加的推动,预计在未来几年BCR-ABL抑制剂的市场将出现高速增长。目前,全球已经批准8款BCR-ABL抑制剂。
二代TKI氟马替尼是我国首个在疗效和安全性上进行“双向优化”的新型TKI。氟马替尼上市数年,无论是上市前临床试验还是真实世界数据上都积累了丰富的循证证据。在FESTnd III期前瞻性随机对照临床研究中,中国初治CML患者按1:1的比例随机分组,分别接受600mg/d剂量的氟马替尼、400mg/d剂量的伊马替尼治疗。
主要终点为6个月时的主要分子学反应(MMR)率。结果发现,相较伊马替尼组,氟马替尼组6个月MMR率明显更高(33.7% vs 18.3%;P=0.0005),达到了研究的主要终点。此外,氟马替尼组12个月MMR率相较伊马替尼也显著增高(48.5% vs 33.0%;P=0.0021),证实了氟马替尼疗效更佳。而在CML治疗备受关注的3个月这一节点,氟马替尼组的MMR率(8.2% vs 2.0%;P=0.0058)、早期分子学缓解(EMR)率(82.1% vs 53.3%;P<0.0001)均显著高于伊马替尼组;更重要的是,氟马替尼组较伊马替尼组12个月时达到完全分子学缓解的患者明显更多。该临床试验结果证实了氟马替尼的优异疗效。
氟马替尼也被一些患者用作二、三线治疗药物。根据华中科技大学同济医学院附属协和医院胡豫教授与黎纬明教授牵头开展的一项多中心、前瞻性研究,目的是探索接受伊马替尼/达沙替尼治疗失败的患者,转换至氟马替尼后的疗效和安全性表现。研究数据结果显示,54%的患者12个月时达到MMR,3个月、6个月时的最佳分子学反应均较基线有显著改善,未发现新的安全性问题,显示了氟马替尼作为伊马替尼和/或达沙替尼治疗失败患者转换治疗用药可为患者带来具有临床意义的疗效改善。综上可见,氟马替尼用于CML治疗表现出了良好的疗效。
2.3 HS-20093 & HS-20089:携手GSK出海
HS-20093—全球进度领先的国产靶向B7-H3 ADC。HS-20093由全人源化的B7-H3单抗与拓扑异构酶抑制剂(TOPOi)有效载荷共价连接而成,目前正在中国进行多项用于治疗小细胞肺癌、肉瘤、头颈鳞癌及其他实体瘤的II期临床研究。根据在2023 ASCO公布的晚期实体瘤中的I期研究数据,结果显示:客观缓解率(ORR)为30.0%,疾病控制率为86.0%,中位无进展生存期(mPFS)为5.4个月。
在小细胞肺癌受试者中,ORR为63.6%,所有肿瘤缓解均在首次有效性评估时发生,mPFS为4.7个月,3个月PFS率达72.7%。3例受试者发生过剂量限制性毒性,最大耐受剂量(MTD)为12.0 mg/kg Q3W。2024年ASCO大会公司公布了HS-20093治疗复发/难治性骨肉瘤患者的2期试验ARTEMIS-002的研究数据:接受12.0 mg/kg HS-20093治疗的患者(共10例)ORR为20.0%。在12.0mg/kg组的患者中观察到2例确认的部分缓解,并一直保持缓解直至最后一次随访,其中最长的缓解持续时间为4.0个月。
接受8 mg/kg HS-20093治疗组的患者的疾病控制率为81.8%(9/11),接受12.0 mg/kg HS-20093治疗组的患者的疾病控制率为100%(10/10)。HS-20089—国产进度第一的靶向B7-H4 ADC。HS-20089是一款靶向B7-H4 ADC,采用了经临床验证的ADC技术,即拓扑异构酶抑制剂(TOPOi)有效载荷,目前正在中国进行用于治疗妇科癌症的II期临床研究。根据在2023 ESMO公布的首项人体/I期试验数据,结果显示:在33例可评估疗效患者中,8例达到部分缓解(PR),缓解率为24.2%,疾病控制率(DCR)为63.6%。16例三阴性乳腺癌(TNBC)患者中的6例达到PR,缓解率为37.5%。在潜在靶向治疗剂量(4.8和5.8 mg/kg)下,三阴性乳腺癌(TNBC)组12例患者有5例PR,缓解率为41.7%。
在安全性上,2例患者中观察到3次剂量限制毒性(DLT,均为7.2 mg/kg),最常见(≥20%)的治疗相关不良事件(TEAE)为白细胞减少、中性粒细胞减少、恶心、贫血、血小板减少、呕吐、疲劳、丙氨酸转氨酶升高、厌食、天冬氨酸转氨酶升高和低钠血症。未报到间质性肺疾病和输液反应。翰森制药和葛兰素史克(GSK)于2023年12月签订关于HS-20093的独家许可。
根据协议,GSK将获得HS-20093的全球独家权利(不包括中国大陆、香港、澳门和台湾地区)推进HS-20093的临床开发和商业化,同时GSK将支付1.85 亿美元预付款,其成功里程碑高达15.25 亿美元。HS-20093商业化后,GSK将按中国大陆、香港、澳门和台湾地区以外的全球净销售额分级支付特许权使用费。
此前,2023年10月翰森制药与GSK就HS-20089达成协议,将HS-20089的全球独家权利(不包括中国大陆、香港、澳门和台湾地区)授权GSK。根据协议,公司将收取8,500万美元首付款并有资格收取最多14.85亿美元的里程碑付款,以及全球净销售额分级支付特许权使用费。
3.中枢神经领域:长期优势领域
中枢神经系统也是翰森制药长期以来的优势领域,在集采前市场份额连续五年全国第一,产品主要以精神类药物为主。根据米内网数据显示,翰森制药问鼎2022年重点省市公立医院终端抗抑郁化药市场份额第一名。在创新布局上,翰森引进的昕越(伊奈利珠单抗注射液)是全球唯一获批用于AQP4抗体阳性的视神经脊髓炎谱系疾病(NMOSD)成人患者治疗的人源化抗CD19单抗,于2022年3月获批上市,标志着公司正式进入罕见病以及创新生物药赛道。
3.1伊奈利珠单抗:全球FIC人源CD19单抗
伊奈利珠单抗是公司于2019年以最高超2.2亿美元总额引进自VielaBio公司的一款抗CD19单抗。2022年3月在国内获批上市,用于AQP4抗体阳性的NMOSD成人患者的治疗,并于2023年1月新增纳入国家医保目录。这是国内首款靶向抗CD19单抗药物,也成为翰森制药通过BD引进并成功商业化的首个重磅创新药,同时也是翰森制药生物药领域从零到一的里程碑式突破。视神经脊髓炎频谱疾病(NMOSD)是一种慢性,自身免疫性疾病,其特征是中枢神经系统反复发作,导致永久性神经损伤和累积性残疾,大部分患者体内都存在水通道蛋白4(AQP4)抗体(临床确诊的重要依据之一)。
NMOSD好发于青壮年,平均发病年龄35-40岁,东亚人群患病率较高。患者以女性多见,在AQP4抗体阳性患者中女性患者占比高达90%。目前NMOSD的确切病因尚不明确,通常认为与遗传、环境及感染相关。NMOSD可伴发其他自身免疫性疾病,如系统性红斑狼疮、干燥综合征、桥本甲状腺炎、重症肌无力等,部分患者可合并肿瘤。目前获批NMOSD适应症的药物包括伊奈利珠单抗(CD19)、萨特利珠单抗(IL-6)、依库珠单抗(C5),而传统免疫抑制剂,如硫唑嘌呤(AZA)、吗替麦考酚酯(MMF)等均属于超适应症用药,且口服传统免疫抑制剂治疗的长期疗效数据稀缺。根据医药魔方的数据,伊奈利珠单抗给药剂量(单次300mg)与给药频次(半年一次,全球唯一)均低于其他产品(7天一次),患者依从性更高。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)