2024医药行业报告:肿瘤小分子药物市场新篇章
1、和黄医药:具有国际视野的小分子肿瘤创新药研发企业
1.1、和黄医药:最早聚焦小分子肿瘤药领域的创新药企业
和黄医药是中国最早聚焦肿瘤小分子创新药的企业,也是最早布局全球市场的具有国际视野的新药研发药企。和黄医药创立于2000年,是中国最早一批进行小分子创新药研发的药企,也是中国首批专注于全球市场的医药研发企业之一。公司于2006年在伦敦交易所上市,2016年在纳斯达克上市,2021年在港交所上市,实现了中、美、欧"三地"上市。过去的20年里,和黄医药建立了世界一流的具有发现及开发能力的全面整合型研发创新平台,致力于将自主发现的抗肿瘤候选药物带向全球患者,也在中国市场建立了自主商业化平台,营销及经销自主研发或第三方合作药物产品。
公司药物管线布局广泛,国际大药企助力开发新药。截至2023年底,公司共有13款小分子候选药物进入临床研究阶段,其中有三款抗肿瘤药已在国内获批上市,并全部被纳入国家医保药品目录,其中一款已在中美两地获批。截至2024年2月28日,公司已同时开展了7种候选药物的超15项注册/注册意向研究,预计未来三年内或全部提交新药上市申请或补充申请。公司于2011年达成与阿斯利康的合作协议后,陆续与多家国内外大药企合作,合力快速推进创新药物的全球开发进程。合作药企除阿斯利康外,还包括礼来、武田制药以及百济神州等国际药企。
1.2、公司国际化管理团队专业背景深厚,管理经验丰富
公司国际化管理团队专业背景深厚,管理经验丰富。和黄医药拥有一支具有国际化视野且经验丰富的管理团队,核心团队成员十分稳定。
苏慰国博士担任公司首席执行官及首席科学官。苏慰国博士自2017年起担任公司执行董事及自2022年3月4日起担任公司首席执行官。自加入公司以来,苏博士带领进行所有药物的发现及研究,包括作为肿瘤/免疫业务的关键领导人策划科学策略,亦负责发掘公司管线中的每一种小分子候选药物。于2005年加入公司前,苏博士曾于辉瑞公司美国研发部门工作。苏博士拥有复旦大学化学学士学位,哈佛大学化学博士学位,且师从诺贝尔奖得主E.J.Corey教授,拥有很强的专业能力和丰富的药物研发经验。
石明博士担任公司医药执行副总裁、研发负责人兼首席医学官。于2022年加入公司前,石博士曾任创胜集团的全球研发负责人兼首席医学官,期间负责将七个项目推进临床开发及多项临床前候选药物提名。石博士曾在诺华工作超过15年,担任过多个高级领导人员职位,包括全球项目临床负责人。石博士是美国临床肿瘤学会、欧洲肿瘤学会、美国血液学会、美国癌症研究协会、中美医药协会的成员,也是美中抗癌协会(USCACA)的执行委员会成员。石博士拥有北京协和医学学士学位,南加州大学分子药理学和毒理学博士学位,之后于哈佛大学医学院进行博士后研究。
1.3、公司实体瘤药物进入全球收获期,自免药物有望即将在国内获批
公司营业收入快速增长。根据公司2023年中报及年报,公司全年总收入为8.38亿美元,同比增长96.52%,归母净利润为1.01亿美元,同比增长127.93%。2023年公司的归母净利润首度实现盈利,主要是由于收到来自武田制药(呋喹替尼授权协议)的4亿美金不可退回首付款,其中2.8亿美元已于2023年确认为收入,其余则记录为递延收入。
公司在实体瘤治疗领域已进入全球收获期。公司在治疗实体瘤领域目前共获批上市了三款小分子新药,包括呋喹替尼、赛沃替尼以及索凡替尼。呋喹替尼三线治疗结直肠癌患者已于中国和美国地区获批上市,欧洲及日本的NDA申请也已完成递交;呋喹替尼联合疗法治疗胃癌和子宫内膜癌已获CDE受理,预计呋喹替尼将于2025年前在多个国家获批多项适应症,进入全面收获期。索凡替尼已在中国获批用于治疗非胰腺及胰腺来源的神经内分泌瘤,联合PD-1二线治疗神经内分泌癌已经进入注册临床,预计于2025年递交上市申请。赛沃替尼最早于2021年在中国获批用于治疗经治MET外显子14跳变的非小细胞肺癌患者;一线治疗NSCLC突变患者的上市申请已于2024年获得CDE受理;赛沃替尼联合泰瑞沙二/三线治疗NSCLC的上市申请预计将于2024年底和2025年分别向FDA和CDE递交。根据2023年年报,3款上市药物已为公司带来近1.64亿美元的销售收入,同比2022年增长了32%。
多款血液瘤和自免领域药物有望即将在中国获批。在血液瘤及自免领域,公司目前有两款进度较快的小分子新药,包括索乐匹尼布和他泽司他。索乐匹尼布于2022年获CDE纳入突破性治疗药物品种,用于治疗免疫性血小板减少症患者,于2024年1月CDE受理了索乐匹尼布的上市申请。他泽司他(EZH2抑制剂)最早于2022年在中国海南先行区获批,用于治疗上皮样肉瘤患者和滤泡性淋巴瘤患者,于中国开展的桥接试验目前已完成,预计于2024年中向CDE递交上市申请。
公司2023年研发费用首度下降。2022年公司研发费用3.87亿美元,2023年研发费用下滑22%至3.02亿美元,主要是因为公司对管线产品进行战略排序,降低了研发支出。
1.4、公司通过自有商业化平台及与MNC合作,全力开拓全球市场
公司的商业化平台已经覆盖超过三千多家重点医院和肿瘤中心。截至2023年年中,公司肿瘤药物商业化团队拥有超过900名员工,覆盖中国30个省和直辖市的三千多家重点医院及肿瘤中心和逾3.3万名肿瘤科医生。公司除肿瘤及自免业务外,还有大规模的药物营销和分销平台,有超过2900名生产和商业化人员,覆盖超过290个城镇。其中,上海和黄药业负责管理其产品在院内的医学说明及市场营销;国控和黄是专注于处方药商业化服务,不仅负责公司自研产品,也向中国的第三方医药公司提供服务。
公司与多家跨国药企合作推进产品,进行全球布局。公司于2013年10月起,就呋喹替尼在中国的专利许可、合作开发及商业化与礼来签订协议。自呋喹替尼于2018年11月底上市起,公司已开始分批从其净销售额中取得许可费。公司于2011年与阿斯利康就赛沃替尼签订全球专利许可、合作开发及商业化协议。公司于2023年1月与武田制药就呋喹替尼在除中国内地、香港地区及澳门地区以外全球范围的针对所有适应症的开发及商业化订立独家许可协议。随着独家许可协议的完成,公司已经收到来自武田制药的4亿美金不可退回首付款,并可额外收取高达7.3亿美元的潜在里程碑付款,外加基于净销售额的特许权使用费。
2、呋喹替尼:多种适应症在全球市场陆续落地,有望持续打开销售天花板
2.1、呋喹替尼是靶向VEGFR1/2/3的肿瘤血管生成抑制剂
呋喹替尼是和黄医药第一个获批上市的产品。呋喹替尼是一种高选择性的血管内皮生长因子受体(VEGFR 1、2及3)的口服抑制剂,于2018年在中国获批用于既往接受过氟尿嘧啶、奥沙利铂和伊立替康为基础化疗以及既往接受过或不适合接受抗VEGF、EGFR治疗的转移性结直肠癌患者的三线治疗。
呋喹替尼是血管内皮生长因子受体(VEGFR)抑制剂,具有较好的肿瘤靶向性及安全性。正常的血管系统的动态平衡是靠血管调节因子共同作用而维持,调节血管生成的因子有两类,即血管生成促进因子和血管生成抑制因子,血管内皮生长因子(VEGF)是最为常见的一种血管生成促进因子,它作用于内皮细胞,在促进血管形成、抑制内皮细胞的凋亡及提高血管通透性等方面发挥重要作用。血管内皮生长因子(VEGF)通过与血管内皮生长因子受体(VEGFR)结合后发挥促进血管形成等作用,使肿瘤细胞获得血管提供的生长所必需的营养和氧气。血管内皮生长因子受体抑制剂是通过抑制血管内皮生长因子受体(VEGFR)磷酸化及下游信号转导,抑制血管内皮细胞的增殖、迁移和管腔形成,从而抑制肿瘤新生血管的形成,肿瘤便无法获得营养和氧气,达到“饿死肿瘤”的目的。VEGFR-1(FLt-1)、VEGFR-2(KDR)、VEGFR-3这3种类型VEGFR亚型组成了VEGFR家族。根据呋喹替尼临床前数据,呋喹替尼抑制VEGFR-1、2和3的IC50值分别为33、35和0.5nmol/L,而抑制原癌基因酪氨酸蛋白激酶受体RET、成纤维细胞生长因子受体FGFR-1以及酪氨酸蛋白激酶c-kit的IC50值分别是128、181和458nmol/L,证明了呋喹替尼对VEGFR-I、2和3靶点具有高度选择性。这说明呋喹替尼在对VEGFR靶点产生抑制作用的同时,有较小的脱靶毒性。
2.2、呋喹替尼市场空间巨大,已在近十种肿瘤中展现治疗潜力
VEGF/VEGFR在几乎所有的人体肿瘤中皆有过表达。血管内皮生长因子/因子受体(VEGF/VEGFR)在肺癌、甲状腺癌、乳腺癌、血管瘤和中枢神经系统肿瘤等多种肿瘤中表达,并诱导形成异常肿瘤血管,刺激肿瘤血管形成,使血管易漏、扭曲,不成熟,促进肿瘤细胞的生长和转移。VEGF/VEGFR参与肿瘤生长的整个过程,出现于整个肿瘤生命周期中,即使随着时间延伸,可能出现第二条通路,VEGF/VEGFR仍处于过表达状态,仍然是最重要的血管生成因子。
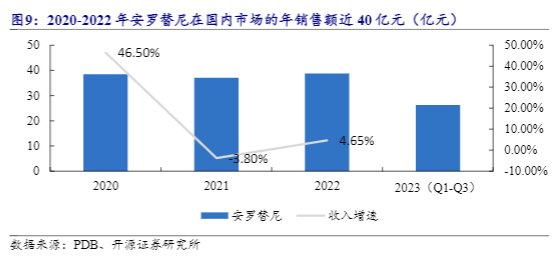
VEGF/VEGFR类药物市场空间巨大,已经在近二十种癌症中获批使用。截至2024年5月,全球已获批上市的靶向VEGF/VEGFR的新药有29个,其中20个是小分子靶向药物。VEGF/VEGFR靶向药物已在近二十种癌症领域获批,最为常见的有结直肠癌、肝癌、肾癌、胃癌等。最早上市的小分子VEGF/VEGFR抑制剂如索拉非尼、舒尼替尼的全球销售峰值达超过10亿美元以上。新一代的抗血管生成抑制剂仑伐替尼(原研)2022年全球销售额达到了19.06亿美元(仅卫材药业报表收入)。在中国,安罗替尼(原研及仿制药)近三年的销售额稳定在40亿人民币,可见抗血管生成抑制剂的潜在市场范围广,市场空间巨大。
呋喹替尼已在多种癌种中展开临床试验,适应症范围不断拓宽。呋喹替尼单药治疗转移性结直肠癌于2018年在中国获批,2019年进入医保目录,2023年11月FDA批准呋喹替尼治疗成人转移性结直肠癌患者的上市申请。呋喹替尼联合化疗2L治疗胃癌于2023年4月获NDA受理,有望于2024年Q3获批;呋喹替尼联合PD-1单抗2L以上治疗子宫内膜癌在中国获得突破性疗法认定,且上市申请已于2024年4月获CDE受理;呋喹替尼已于2023年分别向欧洲和日本提交了NDA申请。除此之外,呋喹替尼联合PD-1单抗在治疗肾细胞癌以及转移性结直肠癌的早期临床试验中均展现了较好治疗效果,目前肾细胞癌已经进入注册临床试验阶段。呋喹替尼已经在7种癌症中展开临床试验,其适应症范围不断拓宽。
2.3、结直肠癌药物竞争格局良好,呋喹替尼市占率持续处于领导地位
全球结直肠癌患者数量庞大,是我国第二大癌种。根据Global Cancer Observatory的数据,结直肠癌(CRC)是全世界第三常见的癌症,约占所有癌症病例的10%,也是全世界癌症相关死亡的第二大原因。
晚期结直肠癌预后差,存在明确未满足临床需求。结肠癌根据病理表现可分为I~IV期。不同分期的生存率或存活率不同,早期(I~III期)患者5年生存期在44%~95%,患者越早期治疗生存率越高,但由于结直肠癌在早期阶段通常没有症状,部分患者在初诊时已经是肿瘤转移(IV期),而肿瘤转移期患者5年生存率不足10%,存在较大的未满足临床需求。
全球范围内开展了多个临床研究,纳入了不同地区、不同人群亚组的晚期结直肠癌患者,相较于安慰剂,呋喹替尼治疗组均表现出显著的治疗效果。FRESCO是在中国开展的多中心III期临床试验,整个研究纳入了416名经过3L及以上治疗的结直肠癌患者,呋喹替尼组的患者受益明显,患者中位无进展生存期(mPFS)显著延长至3.7个月(安慰剂组仅1.8个月),患者总生存期达到了9.3个月(安慰剂组仅6.6个月)。FRESCO-2是在全球的14个国家招募了691名晚期结直肠癌患者,患者均是既往接受过标准化疗及相关生物制剂治疗后疾病进展且对TAS-102和/或瑞戈非尼(指南推荐用药)不耐受的患者,结果显示呋喹替尼患者组的无进展生存期(mPFS)为3.7个月(安慰剂组1.8个月),患者总生存期(OS)为7.4个月(安慰剂4.8个月),患者显著受益。
本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。