2024银屑病治疗药物行业分析报告:市场扩容与国产替代加速
银屑病概述及发病机制
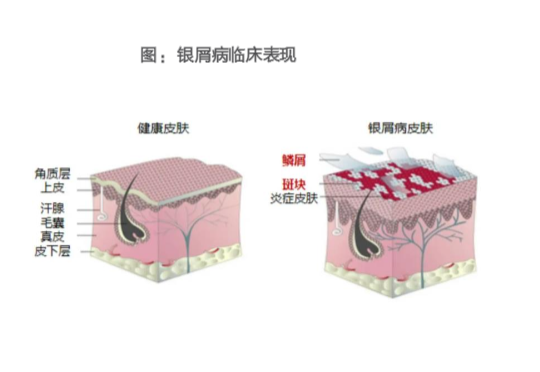
银屑病是一种遗传与环境共同作用诱发的免疫介导的慢性、复发性、炎症性、系统性疾病。临床表现为鳞屑性红斑或斑块,局限或广泛分布。银屑病可合并系统疾病,严重影响患者的生活质量。银屑病的确切病因尚未完全阐明,但遗传、免疫与环境因素在银屑病的发生中发挥重要作用。遗传是银屑病发病的主要风险因素,白细胞介素23(IL-23)和辅助性T细胞17(Th17)细胞相关的免疫通路是银屑病发病的核心机制。免疫因素:T细胞、树突细胞、中性粒细胞和角质形成细胞等多种细胞,通过肿瘤坏死因子α(TNF⁃α)、γ干扰素(IFN⁃γ)、IL⁃17和IL⁃22等细胞因子,引起银屑病特征性变化,包括中性粒细胞浸润、血管生成。活化的树突细胞等可产生IL⁃12和IL⁃23,诱导Th1、Th17和Th22细胞活化或增殖,产生TNF⁃α、IL⁃17和IL⁃22等细胞因子,刺激角质形成细胞过度增殖及产生相关的细胞因子和趋化因子,形成炎症循环。
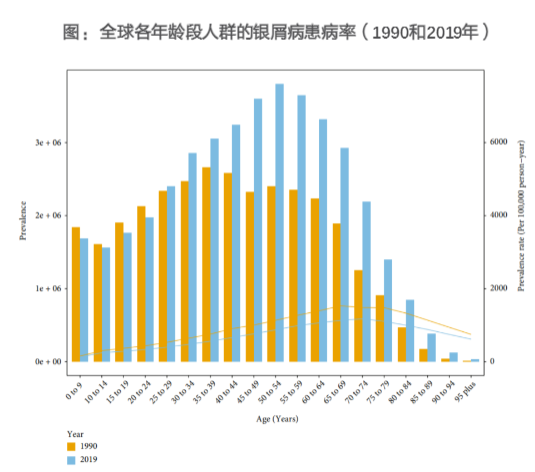
2019年,全球约有4000万人患有银屑病,其中460万为新发病例。根据GBD2019研究,不同国家的银屑病患病率在0.09%~3.34%之间,中国为0.56%。在全球范围内,2019年的银屑病患病率在年轻人中略有下降,在25岁以上人群中有所增加,峰值出现在50~54岁人群中。1984年中国流行病学调查显示,银屑病患病率为0.123%,2008年中国6省市银屑病流行病学调查结果为0.47%,相比欧美国家的患病率为2%~4%)。关节病型银屑病(PsA)在我国银屑病患者中的发生率为0.69%~5.8%,与亚洲其他国家类似(1%~9%),但低于欧美国家(10%~48%)。
根据GlobalMarket数据,以白介素、TNF-α、维生素D等治疗药物计算的全球银屑病治疗市场(2022年)规模为265亿美元。由于民众对银屑病的认识提高,对针对银屑病有效治疗手段的需求也同步提高,相关研发管线数量持续提升。预计到2032年全球银屑病市场规模将达到605亿美元左右,期间保持以8.6%的复合年增长率(CAGR)增长。据弗若斯特沙利文报告,2021年,我国银屑病药物市场规模为11亿美元,预计于2030年将增长至95亿美元,复合年增长率为27.1%,增速远高于全球。
美国银屑病治疗领域药物市场销售规模大,呈现多靶点竞争格局
靶向治疗为中重度银屑病患者带来了新选择。截至2022年底,美国FDA批准了多款用于治疗中重度斑块型银屑病的生物制剂。目前靶向治疗主要包括靶点在细胞膜外的大分子生物制剂,例如TNF-α、IL-17A、IL-12/23等;以及靶点在细胞膜内的小分子药物,例如PDE4、TYK2等。生物制剂因其显著的疗效和安全性,已成为治疗中重度银屑病的主要选择。
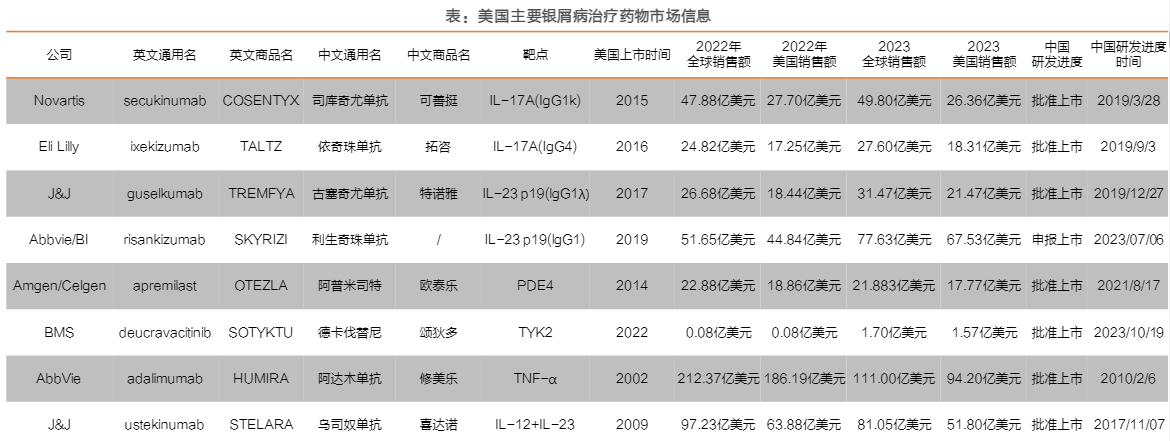
银屑病治疗市场规模超百亿美元,多个靶点药物全球市场表现出色。美国已上市的银屑病靶向药物表现出强劲的增长势头和广阔的市场前景,部分药物销售额亮眼。早年上市的阿达木单抗在2022年的全球销售额高达212.37亿美元;乌司奴单抗2022年销售额达97.23亿美元,成为强生旗下销售额最多的药物。利生奇珠单抗于2019年上市,2022年全球销售额突破50亿美元,在全球三大药物市场取得重要地位,目前正在等待中国上市批准。我们预计未来银屑病药物市场或将继续增长,更多新药的研发和上市有望进一步推动市场的发展。
银屑病治疗药物临床数据对比——生物制剂
司库奇尤单抗虽然表现出更快速的疗效,古塞奇尤单抗在其长期疗效方面更加具有优势。一项观察性、回顾性、单中心队列研究纳入111例中重度银屑病患者,分别接受司库奇尤单抗(n=27)、乌司奴单抗(n=61)和古塞奇尤单抗(n=23)治疗,随访56周,主要结局评估包括PASI75、PASI90和PASI100应答率。在PASI75应答方面,司库奇尤单抗在第16周的疗效优于古塞奇尤单抗和乌司奴单抗;到56周时,古塞奇尤单抗的PASI75应答率显著优于司库奇尤单抗和乌司奴单抗;在PASI90应答方面,观察到与PASI75相同的差异,第16周时,司库奇尤单抗的疗效最优,56周时,古塞奇尤单抗具有最高的PASI90应答率;在PASI100应答方面,与PASI75和PASI90应答具有相同的趋势。安全性类似:在使用司库奇尤单抗、乌司奴单抗和古塞奇尤单抗的患者中,发生至少一次AE的患者比例相似,分别为18.5%、18.0%和17.4%,都具有较好的安全性。
IXORA-R是比较古塞奇尤单抗(IL-23抑制剂)和依奇珠单抗(IL-17A抑制剂)的随机、多中心、头对头的IV期临床研究,共纳入1027位中重度斑块型银屑病患者,试验主要终点是12周的PASI100应答,次要终点中最主要的是第24周的PASI100应答。第12周结果显示,依奇珠单抗组PASI100应答比例高于古塞奇尤单抗组(p<0.001)。第24周数据显示:古塞奇尤单抗第24周获得PASI100比依奇珠单抗更高。依奇珠单抗改善患者生存质量数据优于古塞奇尤单抗。PRO结果显示,与古塞奇尤单抗组相比,依奇珠单抗组达到瘙痒NRS改善≥4、PatGA改善≥2分,PatGA(0,1)的患者比例在第1周时显著较高,两组结果具有统计学差异。第4周时,依奇珠单抗组达到DLQI(0,1)、瘙痒NRS=0、皮肤疼痛VAS=0的应答率显著高于古塞奇尤单抗组。在12周的随访实践中,与古塞奇尤单抗组相比,依奇珠单抗组患者PRO应答率始终在数字上较高。
司库奇尤单抗(IL-17A)起效快于乌司奴单抗(IL-12/IL-23)。与IL-12/IL-23抑制剂乌司奴单抗头对头的临床III期CLEAR研究中,治疗第1周时司库奇尤单抗组患者的PASI75应答率即显著优于乌司奴单抗组,并在第2周时有显著更高的PASI90及IGA0/1应答率,第4周时有显著更高的PASI100应答率,意味着司库奇尤单抗起效更快速。司库奇尤单抗能有效改善患者生活质量。对患者银屑病相关瘙痒、疼痛、鳞屑(Scaling)症状的评估显示,司库奇尤单抗在52周治疗期间的任意时间点,对患者上述三种症状的改善效果都优于乌司奴单抗,且在第4周时即体现出优势;在皮肤病生活质量评分(DLQI)0/1应答率方面,与乌司奴单抗相比,在所有评估时间点,司库奇尤单抗300mg组DLQI0/1应答者的比例显著增加,并持续到第52周。
古塞奇尤单抗(IL-23)长期疗效优于司库奇尤单抗(IL17A)
ECLIPSE研究是全球首个比较IL-23抑制剂(古塞奇尤单抗)与IL-17A抑制剂(司库奇尤单抗)长期疗效和安全性的头对头研究。ECLIPSE研究为多中心、双盲、随机对照的III期临床试验,共纳入了1048名中重度斑块型银屑病患者,研究的主要终点是第48周的银屑病皮损完全清除比例(PASI)90应答。ECLIPSE研究显示,IL-17制剂(司库奇尤单抗)起效快于IL-23(古塞奇尤单抗)。头对头数据显示,古塞奇尤单抗(IL-23)长期疗效优于司库奇尤单抗(IL17)。48周结果显示,IL-23患者PASI90应答比例显著高于IL-17组(84.5%vs70.0%),PASI100应答比例分别为58.2%和48.4%。
利生奇珠单抗(IL-23)头对头结果优于司库奇尤单抗(IL-17A)。利生奇珠单抗与司库奇尤单抗头对头治疗银屑病的临床III期研究(IMMerge研究)结果显示,在治疗52周后,接受利生奇珠单抗治疗的患者达到PASI90的比例高达87%,而司库奇尤单抗的的比例为57%。在16周的结果也表现出了非劣,利生奇珠单抗与司库奇尤单抗的PASI90分别为74%与66%。此外,司库奇尤单抗在第四周PASO数据显著优于利生奇珠单抗,保持了起效快的优势。此外,利生奇珠单抗在第0周和第四周给药后,后续每12周给药一次,在患者用药便利性上拥有明显优势。
银屑病生物制剂的长期疗效数据对比
司库奇尤单抗起效快,3年内PASI评分持续下降。PURE研究3年结果表明,接受司库奇尤单抗治疗的受试者在接受治疗3个月时,PASI评分即出现大幅下降,3个月时平均PASI为2.3。在3年随访时间里,患者平均PASI持续下降,36个月时患者平均PASI下降至1.6。结果显示,无论患者体重是否>90kg,司库奇尤单抗治疗的银屑病患者平均PASI评分均呈持续下降的趋势。依奇珠单抗5年长期数据显示出持续高效性和安全性。研究数据显示,当患者使用依奇珠单抗治疗208周和260周时(四年到五年),PASI平均值分别为0.9和0.7,32.8%的患者停药(主要原因是原发性治疗失败),显示持续高效性和安全性。此外,一项比较IL-17A抑制剂用于银屑病治疗持续性的真实世界研究结果表面,依奇珠单抗停药的可能性要小于司库奇尤单抗。
大/小体重基数患者调整应单次用药量,用药频次保持不变
中国银屑病生物治疗专家共识指出,生物制剂治疗银屑病时,给药方案应当与患者体重相匹配。如乌司奴单抗(IL-12/23p40)标准用量为每次45mg,但针对体重大于100kg的患者,每次剂量应增加到90mg;同时,司库奇尤单抗每次用量为300mg,针对体重小于50kg的患者,剂量应调整至150mg。针对儿童用药,根据《中国儿童银屑病生物治疗专家共识(2021)》,司库奇尤单抗在儿童银屑病治疗中的使用剂量应按照患儿体重进行划分:体重<50kg的患儿推荐剂量为75mg/次,体重≥50kg的患儿推荐剂量为150mg/次(可提高至300mg)。
生物制剂在储存和运输中容易受外界因素影响而被污染、失活、变质,从而存在安全隐患。因此生物制剂储存和运输中的相关负责人需严格对运输和储存环节中的条件进行控制,以保障药品的质量。生物制剂储存和运输中的核心是低温环境的控制。应在规定的运输条件下采用最快速的运输方式,缩短运输时间,以保证易失活、变性药品的品质,其核心是保持低温环境。运输时应注意防止制品冷冻,应避免运输过程中震动对制品质量的影响;应在运输全过程,包括装卸搬运、变更运输方式、更换包装设备等环节始终保持一定温度。此外,乌司奴单抗注射液、依奇珠单抗注射液、古塞奇尤单抗注射液、司库奇尤单抗注射液等靶向白介素(IL)的生物制剂使用前需恢复室温,且禁止摇晃。
后续适应症持续开发。司库奇尤单抗于2015年1月获得美国FDA和欧洲批准,用于治疗中重度斑块状银屑病患者。一年后美国FDA批准用于强直性脊柱炎和银屑病关节炎。2020及2023年新增中轴型脊柱关节炎及化脓性汗腺炎两项适应症。巨细胞动脉炎、肌腱病、风湿性多肌痛症三项新适应症有望于2025年后逐年递交上市申请。全球销售额维持稳定增长。2015年司库奇尤单抗上市后首年实现全球销售额2.61亿美元,随后保持高速增长。2023年全球实现收入49.80亿美元,其中美国实现收入26.36亿美元。
2019年4月1日,诺华的司库奇尤单抗(商品名:可善挺)在华上市,用于治疗符合系统治疗或光疗指征的中度至重度斑块状银屑病的成年患者;2020年司库奇尤单抗成功纳入医保目录,开始加速放量。医药魔方数据显示:样本医院,2021/2022/2023年司库奇尤单抗销售额分别为6.11/14.24/18.39亿元。分品种看,2023年司库奇尤单抗(靶点:IL-17)销售额占比最高,随后是阿达木单抗(靶点:IL-17TNF-α)、依那西普(靶点:LTα×TNF-α)、英夫利西单抗(靶点:IL-17TNF-α)。2019年诺华公布了441位中国患者使用司库奇尤单抗治疗中至重度斑块状银屑病有效性及安全性的最新52周的III期研究数据。临床数据显示:近九成接受司库奇尤单抗300毫克治疗的患者在16周内达到皮损清除或几乎清除,且症状早在治疗开始后第3周即得到迅速缓解。在疗效和安全性方面优于部分国际数据。
司库奇尤单抗:积极拓展下沉渠道,通过医保/返款政策持续提高药物可及性
积极拓展县域下沉渠道。司库奇尤单抗上市后借助医保、医联体等持续拓展下沉渠道,患者可通过县域医院购药并享受省城医保报销政策,大大提高药物可及性。司库奇尤单抗上市后价格持续下降。司库奇尤单抗于2019年4月在国内上市,上市价格为2998元/支;2020年司库奇尤单抗纳入国家医保目录,价格医保前的2998元/支降至1188元/支。2023年司库奇尤单抗以870元/支的价格续约,价格进一步下降。不考虑返款政策,司库奇尤单抗年治疗费用为35640元/年(导入期)、28512元/年(维持期),依奇珠单抗年治疗费用低至19488元/年(导入期)、14616元/年(维持期)。返款政策进一步提高司库奇尤单抗药物可及性。为了提高药物可及性,“一路挺你”2023权益项目正式延期。经专业医生评估后被推荐使用可善挺(司库奇尤单抗)治疗的符合药品说明书适应症的患者均可提交项目入组申请。全自费患者(870元每针购药)可通过该福利项目申请87元每针的报销;医保患者报销后每针自付100元,通过项目可再报销10元。
2023年10月,可善挺静脉注射剂获得FDA批准上市,用于治疗强直性脊柱炎和非放射学中轴型脊柱关节炎。原有皮下注射将药液注射到皮肤与肌肉之间的疏松组织中,能够迅速达到药效,操作较为简单,但会存在注射部位反应;静脉注射将药液直接注射到血管内,药物是直接加入体循环,快速形成较高血药浓度。由于静脉注射直接与血红蛋白结合,所以不存在吸收损失,因此药物利用率更高。2020年6月,可善挺自感随心笔®装(SensoreadyPen)在国内获批,可用于治疗中度至重度的斑块状银屑病。作为预装式注射器的升级版本,有望为患者提供便捷给药手段,提高疾病管理的依从性。FEATURE与JUNCTURE2项III期研究的结果显示,第48周时,使用AI(自动注射笔)的受试者自我注射感受高达8.92分,自信评分高达9.02分,治疗满意度高达9.23分评分范围为[0分(体验差)~10分(体验好)]。此前,全球范围内日本于2014年获批手动针注射液,美国于2015年获批自动针注射液。
银屑病治疗靶点多样,重要靶点IL17、IL23A及TYK2国内多家厂商积极布局。当前国内上市3款IL17相关靶点、2款IL23A(IL23p19)靶点、1款TYK2靶点银屑病抗体/小分子药物。国产管线中IL17A进度领先,恒瑞医药、智翔金泰所研药品均处于上市申请阶段,另有华奥泰等多家正在推进III期临床。IL23A靶点药物中,信达生物的IBI112已递交上市申请,TYK2靶点总体进度稍缓。2024年以来,多家厂商更新管线进度,积极加速推进。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)