2024医药生物行业报告:医保目录调整与OTC产品市场展望
1. 板块观点
1.1. 医药估值极具有吸引力,重点推荐中药OTC及创新药
本周、年初至今医药指数涨幅分别为-0.75%、-15.96%,相对沪指的超额收益分别为0.16%、-19.18%;本周医疗服务(+0.68%)和化学制药(+0.68%)等股价微涨,生物制品(-0.01%)股价微跌,医药商业(-5.78%)、中药(-2.84%)及医疗器械(-0.65%)等股价跌幅较大;本周涨幅居前灵康药业ST三圣(+21.97%)、灵康药业(+11.25%)、天智航-U(+10.93%),跌幅居前益丰药房*ST太安(-58.82%)、长江健康(-18.99%)、益丰药房(-16.57%)。
涨跌表现特点:本周医药板块小市值个股略为强势、药店受到院内外医保支付价影响跌幅更加明显。本周、年初至今港股医药指数涨跌幅分别为-0.7%、-23%;医疗器械、生物制品及化药等股价出现一定程度涨幅;医药商业、中药及医疗服务等跌幅较大;本周涨幅居前心泰医疗(+38%)、永泰生物(+13%)、亚盛医药(+11%),跌幅居前维亚生物(-12%)、来凯医药(-12%)、微创脑科学(-10%)。本周、年初至今港股医药指数涨跌幅分别为-0.7%、-23%;医疗器械、生物制品及化药等股价出现一定程度涨幅;医药商业、中药及医疗服务等跌幅较大;本周涨幅居前心泰医疗(+38%)、永泰生物(+13%)、亚盛医药(+11%),跌幅居前维亚生物(-12%)、来凯医药(-12%)、微创脑科学(-10%)。
【投资策略】具体配置思路:GLP1产业链领域:博瑞医药、信达生物、新诺威、诺泰生物等;药店领域:老百姓、益丰药房等;CGM领域:鱼跃医疗、三诺生物等;中药领域:太极集团、东阿阿胶、佐力药业、方盛制药、达仁堂、康缘药业等;原料药领域:千红制药、同和药业、华海药业、天宇股份等;临床及仿制药CRO:诺思格、泰格医药、百诚医药、阳光诺和等;创新药领域:科伦博泰、恒瑞医药、海思科、迈威生物、泽璟制药、迪哲药业;亚盛医药、和黄医药、信达生物等;医药商业:九州通、国药股份、柳药集团等;IVD领域:新产业、安图生物、亚辉龙等;医疗耗材领域:惠泰医疗、大博医疗、三友医疗等;仿创药领域:吉贝尔、恩华药业、仙琚制药、立方制药、信立泰等;医疗服务领域:爱尔眼科、三星医疗、海吉亚医疗、固生堂等;科研服务领域:药康生物、奥浦迈、百普赛斯等。血制品领域:上海莱士、天坛生物、博雅生物等。
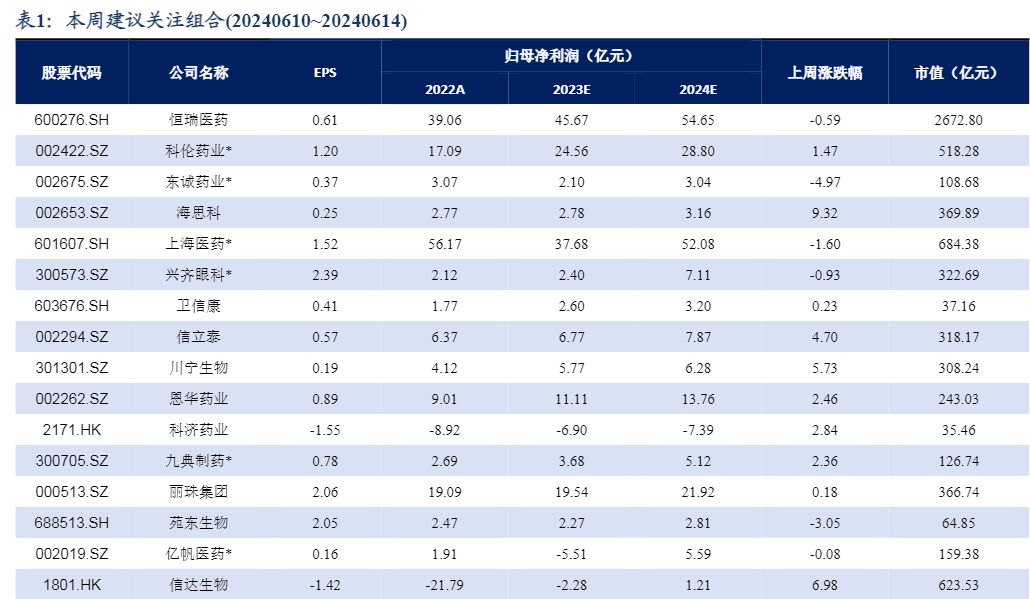
2. 中药OTC产品院内外价格存在差异下,建议关注具有强议价权的OTC龙头
近期,部分城市如西安、深圳等地医保局上线定点零售药店药品比价系统,引发市场担忧,药店板块明显回调,同时市场担忧对中药OTC产品产生影响。根据中康开思数据,我们选取院外零售销售额较高的中药OTC大品种,对比院内挂网价以及线上零售终端价格,存在以下几种情况:(1)上游中药企业对于院内外产品多采用多种规格,一方面,防止不同渠道的窜货,方便把控价格;另一方面,定价具有一定的灵活性。院内外规格的差异带来一定的价差。(2)部分OTC产品不在医保支付范围内,如东阿阿胶的阿胶块。非医保支付范围内的产品不在此次定点零售药店药品比价系统范围内,且消费者在院外购买强消费属性的产品也看重品牌力。(3)部分OTC产品主攻院外市场,无院内挂网价格,不必担心院内外价格拉平,如华润三九的感冒灵颗粒。(4)部分产品院内挂网价格高于院外价格,如东阿阿胶的复方阿胶浆等。我们认为院外产品价格未来将综合医保支付政策、营销策略等综合调整。(5)零售终端价格高于院内价格的产品,零售价格端或有所调整,但对于上游的中药企业,本身院内院外渠道的出厂价存在一定差异,我们建议关注议价能力更强的上游OTC企业。
3. 研发进展与企业动态
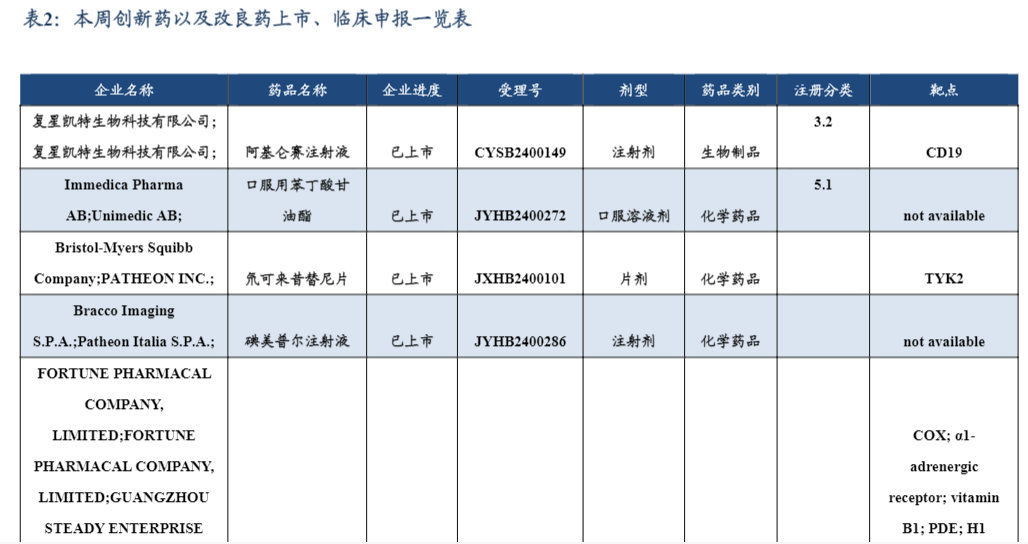
3.1. 创新药/改良药研发进展(获批上市/申报上市/获批临床)
6月13日,BMS宣布FDA已经加速批准Augtyro(repotrectinib)新适应症,用于12岁及以上儿童和成人神经营养因子受体络氨酸激酶(NTRK)基因融合突变局部晚期或转移性实体瘤患者。
6月13日,诺华宣布其JAK抑制剂捷恪卫(芦可替尼片)获得了中国国家药品监督管理局(NMPA)批准新适应症,用于治疗对糖皮质激素或其他系统治疗应答不充分的12岁及以上慢性移植物抗宿主病(cGVHD)患者。
6月12日,诺华宣布,该公司盐酸卡马替尼片(妥瑞达®)获得中国国家药品监督管理局批准上市,用于未经系统治疗的携带间质上皮转化因子(MET)外显子14跳跃突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
6月12日,阿斯利康的Farxiga(达格列净)获美国FDA批准,用于改善10岁及以上2型糖尿病(T2D)患儿的血糖控制。Farxiga此前在美国被批准用于成人患者,作为饮食和运动的辅助药物,以改善血糖控制。
6月12日,药监局网站显示,君实生物的特瑞普利单抗注射液(商品名:拓益)新适应症获批上市,联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗。这是特瑞普利单抗获批的第9项适应症。➢6月12日,药监局官网显示,协和麒麟制药依伏卡塞片(evocalcet)获批上市,用于慢性肾病继发性甲状旁腺功能亢进(SHPT)患者的治疗。
6月12日,国家药监局网站显示,礼来的高血糖素鼻用粉雾剂(Baqsimi)获批上市,用于治疗4岁及以上糖尿病患者的严重低血糖症状。
6月12日,NMPA官网显示,兴盟生物的泽美洛韦玛佐瑞韦单抗注射液获批上市。这是国内首款获批的抗狂犬病毒复方抗体制剂——单抗鸡尾酒疗法产品MAb cocktail product。对于变异性强或者多亚型的病毒感染性疾病,如新冠、狂犬病,鸡尾酒疗法是更优和更安全的治疗手段,可以有效地覆盖突变株免疫的逃逸。
6月11日,再生元和赛诺菲共同宣布,FDA已批准IL-6R单抗Kevzara(sarilumab)用于治疗体重63kg或以上的活动性多关节幼年特发性关节炎(pJIA)患者,pJIA是一种一次影响多个关节的关节炎。6月11日,绿叶制药宣布,其自主研发的第二代抗精神病药长效针剂棕榈酸帕利哌酮注射液(美比瑞)已获得中国国家药品监督管理局的上市批准,用于精神分裂症急性期和维持期的治疗。
6月10日,阿斯利康宣布Tagrisso(奥希替尼)治疗放化疗(CRT)后不可切除的EGFR突变型(外显子19缺失或外显子21(L858R)突变)III期非小细胞肺癌(NSCLC)患者的补充新药申请(sNDA)获FDA受理并予以优先审评。FDA预计将在今年第四季度作出审批决定。
6月9日,卫材和渤健共同宣布仑卡奈单抗(Lecanemab,商品名:Leqembi)静脉注射(IV)剂型的补充生物制品许可申请(sBLA)获FDA受理,用于维持治疗早期阿尔茨海默病(AD)患者,即存在轻度认知障碍或处于轻度痴呆阶段的AD患者。PDUFA日期为2025年1月25日。
6月7日,葛兰素史克(GSK)宣布,FDA批准重组呼吸道合胞病毒(RSV)疫苗Arexvy的适用范围扩大到50-59岁的RSV高危成人。这是首款保护50-59岁高危人群的RSV疫苗。
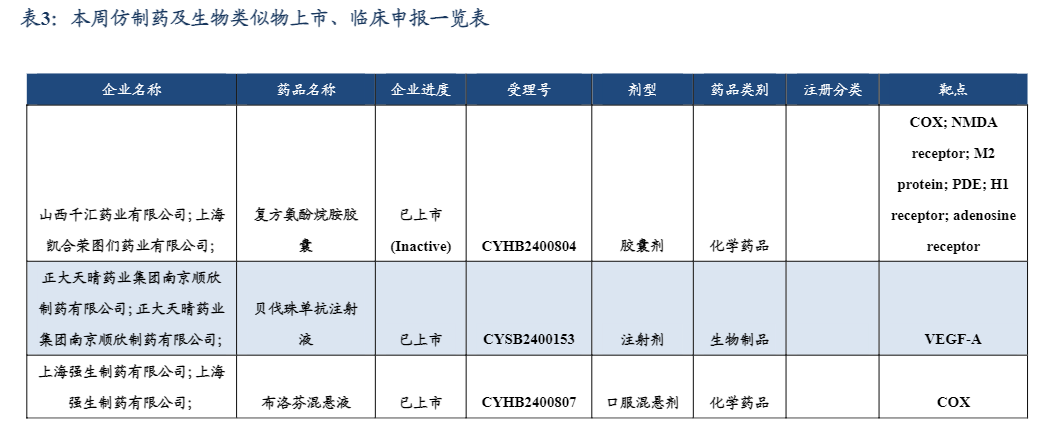
3.2. 仿制药及生物类似物上市、临床申报情况
6月12日,丽珠医药旗下新北江制药司美格鲁肽注射液的上市申请获国家药监局药审中心受理。司美格鲁肽注射液是该公司自主研发的生物类似药,本次注册申请的适应症为:用于在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病患者的血糖控制,及降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险。
3.3. 重要研发管线一览
6月13日,荣昌生物宣布,维迪西妥单抗(商品名:爱地希®)治疗HER2阳性存在肝转移的晚期乳腺癌患者的III期临床取得阳性结果,达到主要研究终点。该项目已于2021年6月获得国家药品监督管理局(NMPA)授予的突破性疗法认定,公司计划近期向国家药品监督管理局药品审评中心(CDE)递交上市申请。这是一项在中国开展的、开放、平行对照、多中心的III期临床研究(RC48-C006,NCT03500380),旨在评价注射用维迪西妥单抗对比拉帕替尼联合卡培他滨用于治疗HER2阳性晚期乳腺癌患者的有效性及安全性。➢6月12日,泽璟制药自主研发的1类新药盐酸吉卡昔替尼片(曾用名:盐酸杰克替尼片)治疗重症斑秃的III期临床主试验(ZGJAK018)达到了主要疗效终点,达到统计显著性(p<0.0001)。泽璟制药表示将加快推进盐酸吉卡昔替尼片治疗重症斑秃患者适应症的上市进程。
6月12日,辉瑞宣布基因疗法Fordadistrogene movaparvovec(PF-06939926)治疗杜氏肌营养不良症(DMD)的III期CIFFREO研究未达到主要终点。
6月11日,康朴生物医药宣布将在欧洲风湿病学大会年会(Annual European Congress of Rheumatology,EULAR 2024)上以壁报形式发布KPG-818用于治疗系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)的2a期临床研究结果摘要。此项研究结果显示,KPG-818 0.15 mg与0.6 mg剂量组12周给药安全性耐受性良好。与安慰剂组相比,0.15 mg剂量组SLEDAI-2K和CLASI评分在12周均得到明显改善。KPG-818显示出良好的药代动力学特征,同时减少了SLE患者的B细胞总量并引起Treg升高。
6月10日,中国生物制药和益方生物在《柳叶刀》期刊上发表了格舒瑞昔(garsorasib,D-1553)治疗KRAS G12C突变型局部晚期或转移性非小细胞肺癌(NSCLC)患者的II期注册性研究数据。
4. 行业洞察与监管动态
6月14日,国家药监局药审中心关于发布《药物临床试验不良事件相关性评价技术指导原则(试行)》的通告。内容为:为指导我国药物临床试验期间安全性研究与风险评价工作,提供可参考的技术标准,按照国家药品监督管理局工作部署,药审中心组织制定了《药物临床试验不良事件相关性评价技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
6月14日,国家药监局药审中心关于发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)》的通告。内容为:按照国家药品监督管理局的部署,药审中心组织制定了《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审核同意,现予发布,自发布之日起施行。
6月14日,国家药监局药审中心关于发布《临床试验期间生物制品药学研究和变更技术指导原则(试行)》和《已上市疫苗药学变更研究技术指导原则(试行)》的通告。内容为:按照国家药品监督管理局的部署,药审中心组织制定了《临床试验期间生物制品药学研究和变更技术指导原则(试行)》和《已上市疫苗药学变更研究技术指导原则(试行)》(见附件1、2)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
6月13日,国家药监局药审中心关于发布《〈已上市化学药品药学变更研究技术指导原则(试行)〉原料药变更的问答》的通告。内容为:为规范和指导当化学原料药的生产工艺、生产场地、生产批量、质量标准等发生变更时,相关制剂持有人应进行哪些研究工作,并进一步明确当制剂所用原料药的供应商发生变更时,相关制剂的技术要求,在国家药品监督管理局的部署下,药审中心组织制定了《〈已上市化学药品药学变更研究技术指导原则(试行)〉原料药变更的问答》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
6月12日,国家药监局药审中心关于发布《化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则》的通告。内容为:为了规范和指导化学仿制药混悬型鼻用喷雾剂的药学研发,在国家药品监督管理局的部署下,药审中心组织制定了《化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
6月12日,国家药监局药审中心关于发布《化学药品注射剂配伍稳定性药学研究技术指导原则(试行)》的通告。内容为:为进一步明确化学药品注射剂配伍稳定性研究技术要求,完善化学药品注射剂评价标准体系,在国家药品监督管理局的部署下,药审中心组织起草了《化学药品注射剂配伍稳定性药学研究技术指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。
5. 行情回顾
本周(2024.6.10-2024.6.14) 生物医药指数下跌0.75%,板块表现强于沪深300指数-0.91%的跌幅,劣于上证指数-0.61%的跌幅;截至6月14日,医药指数2024年初至今跌幅为-15.96%,沪深300至今涨幅为3.22%,上证指数2024年初至今涨幅为1.94%。2020年初国内外新冠肺炎疫情发生,对国内经济,尤其是全球经济一体化形成一定冲击,医疗产业的确定性成为国内外资金追捧对象;但由于医药板块位置高、估值贵、医疗基金收益率高,板块有所回调,目前板块估值已至较低位置。长期来看,医药行业仍将不改持续向好的发展态势。
截至2024年6月14日,医药指数市盈率为30.93倍,环比上周下降0.25倍,低于历史均值8.00;沪深300指数市盈率为11.94倍,医药指数盈利率溢价率为159.0%,环比上周下降0.0%,低于历史均值23.7%。
本周(2024.6.10-2024.6.14) 生物医药指数下跌0.75%,板块表现强于沪深300指数-0.91%的跌幅,劣于上证指数-0.65%的跌幅;子板块中,表现最佳的医疗服务和原料药板块上涨0.68%,最弱势的医药商务板块涨跌幅为-5.78%。2024年初至今,表现最佳的子板块为中药板块,优于生物医药板块-15.96%的跌幅。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)