2024多发性骨髓瘤BCMA靶向疗法行业报告:市场与前景分析
1.1 多发性骨髓瘤是第二大血液瘤,全球年新发患者超30万人
多发性骨髓瘤是第二大血液瘤,全球年新发患者超30万人
据MMRF,多发性骨髓癌是第二大血液癌症,5年生存率为59.8%。
据WHO,2022年全球新发多发性骨髓癌30万例,全球多发性骨髓癌死亡患者18.5万例;我国新发多发性骨髓癌患者3万例,我国发病率为2.1人/10万人;我国多发性骨髓癌死亡患者1.9万例,我国死亡率为1.3人/10万人;美国新发多发性骨髓癌患者3.2万例,美国发病率为9.7人/10万人;美国多发性骨髓癌死亡患者1.3万例,美国死亡率为3.9人/10万人;欧洲新发多发性骨髓癌患者5万例,欧洲发病率为11.2人/10万人;欧洲多发性骨髓癌死亡患者3.2万例,欧洲死亡率为7.1人/10万人。
1.2 多发性骨髓瘤的病因及病理机制
多发性骨髓瘤病因及发病机制
研究表明,多发性骨髓瘤的病因尚不明确,这种疾病可能与免疫系统衰退、某些职业、接触某些化学物质和暴露于辐射有关,但这些联系尚未得到证实。在大多数情况下,多发性骨髓瘤发生在没有已知风险因素的人身上。
多发性骨髓瘤的发病机制:B-Cell经过多种特定遗传损伤(特定染色体的获得或缺失以及Ig相关的染色体异位),在MGUS阶段发生13q缺失重叠、Ras突变、Myc过表达等事件导致致瘤性改变,骨髓瘤细胞向髓外发展则与NF-kappaB,17p缺失等事件相关。
多发性骨髓瘤病理机制表现于对骨、血液和肾脏的影响骨质流失是多发性骨髓瘤最常见的症状,85%的骨髓瘤患者都会出现骨质流失。骨髓瘤通过两种方式导致骨质流失:骨髓瘤细胞在骨髓中形成肿块,破坏周围骨骼的正常结构;骨髓瘤细胞分泌的物质会干扰骨骼修复和生长的正常过程。
越来越多的骨髓瘤细胞影响各类血细胞的生成:白细胞数量减少,增加感染风险;红细胞生成减少,导致贫血,影响凝血功能
肾脏,血液中M蛋白和钙的积累会使肾脏过度劳累,肾脏可能无法正常工作
1.3 多发性骨髓癌分期&分型
多发性骨髓癌的分期:R-ISS分期、ISS分期
多发性骨髓癌的分型:
依照增多的异常免疫球蛋白类型可分为以下8型:IgG型、IgA型、IgD型、IgM型、IgE型、轻链型,双克隆型以及不分泌型。
根据轻链类型分为:κ型、λ型。
2.1 全球多发性骨髓瘤药物市场规模超200亿美元
全球多发性骨髓瘤药物市场规模超200亿美元
全球多发性骨髓瘤市场从2015年102.1亿美元快速增长至2021年262.3亿美元,增长来源主要为CD38单抗达雷妥尤单抗的快速放量。随着免疫调节剂(IMiD)和蛋白酶体抑制剂(PIs)等传统药物面临“专利悬崖“和新药的替代,双抗和CAR-T等新药在后线市场的销售尚未形成规模,2022年开始全球市场规模开始小幅下滑,2023年下滑至225.2亿美元。
2.2 CD38单抗和PIs占据全球主要市场,BCMA靶向疗法占比尚低
CD38单抗和PIs占据全球主要市场,BCMA靶向疗法占比尚低,随着产品获批上市有望快速增长
根据强生等海外各公司年报整理,2023年全球多发性骨髓瘤药物市场以CD38单抗为主的靶向疗法占比高达46.4%,蛋白酶体抑制剂、免疫调节剂和BCMA靶向疗法占比分别为42.4%、6.2%、4.5%,过去十年来CD38单抗销售额迅猛增长,免疫调节剂销售额逐渐萎缩,BCMA靶向疗法崭露头角但占比尚低。
根据PDB样本医院数据,2023年中国多发性骨髓瘤药物市场中,免疫调节剂和以CD38单抗为主的靶向疗法占比接近,分别为36.9%、36.4%,蛋白酶体抑制剂占比26.1%,BCMA靶向疗法上市产品尚仅有2款CAR-T药物。
2.2 CD38单抗和PIs占据全球主要市场,BCMA靶向疗法占比尚低
中美多发性骨髓瘤药物市场中,达雷妥尤单抗、来那度胺占比超60%
根据强生等海外各公司年报整理,2023年全球多发性骨髓瘤药物市场中,达雷妥尤单抗占比高达43.3%,来那度胺、泊马度胺和卡非佐米占比分别为27.1%、15.3%、6.2%。根据PDB数据,2023年,中国多发性骨髓瘤药物市场中,达雷妥尤单抗、来那度胺、多柔比星、伊沙佐米和硼替佐米分别占比33.9%、27.8%、12.4%、11.9%和9.1%。
2.3 BCMA靶向疗法在全球市场的占比尚低,随着产品获批上市有望快速增长
2023年BCMA靶向疗法全球销售10.2亿美元,西达基奥仑赛表现亮眼
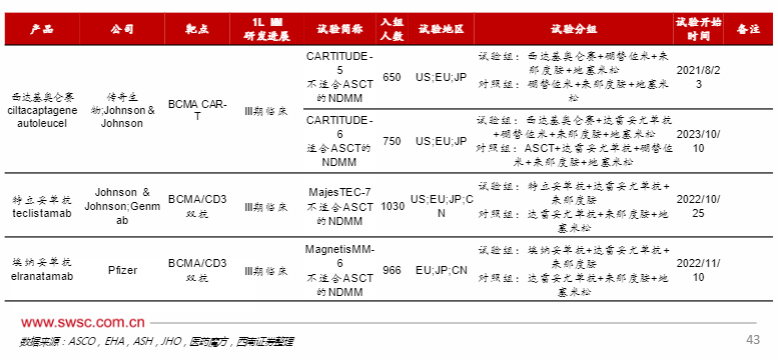
目前全球已有7款治疗多发性骨髓瘤的BCMA靶点药物在2021-2023年之间上市,国内仅2款BCMACAR-T产品上市,据公司公告,BCMA靶向疗法全球销售从2021年2.8亿美元增长至2023年10.2亿美元,主要为西达基奥仑赛、艾基维仑赛贡献,尤其西达基奥仑赛虽然上市时间晚于艾基维仑赛,但2023年销售额已超过艾基维仑赛,2024年4月西达基奥仑赛二线MM适应症获批,是全球首个且 唯一获批多发性 骨髓瘤二线治 疗的CA R-T产品,有望加速放 量。

4.1 多发性骨髓瘤新药靶点主要围绕骨髓瘤细胞表面抗原,在研项目众多
免疫疗法用于新诊断MM(NDMM)和复发/难治性MM(RRMM)的治疗取得了显著进展,被认为是克服免疫抑制性微环境并促进抗肿瘤免疫反应的有力工具,具有诱导免疫记忆以降低复发风险的独特潜力。直接靶向肿瘤细胞表面抗原的免疫疗法是当前MM治疗的快速发展领域,CD38、SLAMF7、GPRC5D和BCMA等靶点在恶性浆细胞表面高表达,已成为MM免疫治疗的热门靶点。
MM适应症CAR-T目前全球4款药物批准上市,III期临床1例,II期临床、I/II期临床和I期临床分别有20例、40例和127例。热门靶点为BCMA和CD19,在批准上市的4款药物与2例III期临床试验中的靶点均为BCMA,CD19虽然研发起始早,但相当部分已经inactive/Unknown。其他新靶点GPRC5D等值得关注。
MM适应症双抗目前全球3款药物批准上市,1款药物申请上市,III期临床2例,II期、I/II期和I期临床分别有1例、10例和15例;批准上市、申请上市以及III期临床药物靶点为5例CD3/BCMA,1例CD3/GPRC5D,CD3靶点在双抗研发中占比高达88.5%。
MM适应症ADC药物目前全球批准上市药物1款,为BCMAADC。II期临床、I/II期临床和I期临床分别有2例、4例和12例。超过一半的项目处于inactive状态。
MM适应症其他机制在研新药包含干细胞疗法、溶瘤病毒、RNAi疗法、核药等,其中干细胞疗法已有处于III期临床阶段项目,溶瘤病毒有处于II期临床阶段的项目。其他大多处于I期临床阶段、近半为inactive状态。
4.2 BCMA靶点百花齐放,GPRC5D等新兴靶点崭露头角
多发性骨髓瘤细胞通过细胞表面粘附分子与骨髓基质细胞(BMSC)和细胞外基质(ECM)结合,从而触发MM细胞在骨髓环境中的生长、存活、耐药和迁移。这些作用既归因于MM细胞-BMSC的直接结合,也归因于各种细胞因子的诱导,包括IL-6、胰岛素样生长因子I型(IGF-I)、血管内皮生长因子(VEGF)和基质细胞衍生生长因子(SDF)-1α。生长、耐药和迁移分别通过Ras/Raf/丝裂原活化蛋白激酶、PI3K/Akt和蛋白激酶C信号级联介导。
配体与BCMA结合后,激活活化B细胞的核因子κ-轻链增强子(NF-κβ)信号。BCMA的主要配体是:B细胞活化因子(BAFF)和增殖诱导配体(APRIL),它们主要由骨髓基质细胞、破骨细胞和巨噬细胞以旁分泌的方式分泌。配体与BCMA结合后,MM细胞中多个生长和存活信号级联被激活,最常见的是活化B细胞的核因子κ-轻链增强子(NF-κβ),这些途径通过调节细胞周期检查点导致MM细胞存活率增加。
BCMA靶向疗法的主要技术类型包括双抗、CAR-T和ADC。
BCMAADC与多发性骨髓瘤细胞表面的BCMA结合后,ADC首先被内化,连接体在溶酶体或核内被水解,释放导致细胞死亡的有效载荷。
BCMACAR-T细胞上的BCMAscFv的外结构域与MM细胞表面的BCMA结合,导致CAR-T细胞的激活,释放细胞毒性细胞因子,导致MM细胞死亡。
双特异性T细胞参与者(BiTE)。含有BCMA-和CD3-scf v的双BiTE同时与CD3和BCMA结合,促进T细胞/MM细胞交联,随后CD4+/CD8+T细胞激活和分泌细胞毒性细胞因子,导致MM细胞死亡
BCMA靶点双抗、CAR-T和ADC的优劣势比较
CAR-T:优势在于拥有极强的应答率与一次性干预的治疗方式,劣势在于其高昂的制造成本、副作用以及需要持续监测;
双抗:优势在于现货属性以及CRS风险相对CAR-T较低,劣势在于其三重/五重难治的数据有限,需要持续用药治疗以及副作用;
ADCs:优势在于现货属性、有效的应答率以及无CRS,劣势在于其三重/五重难治患者的ORR和PFS不高、需要持续用药治疗以及副作用。
4.3 末线(≥3线)MM临床数据:ADC有效性
Blenrep(Belantamabmafodotin)2020年8月获FDA加速批准用于治疗先前经过四线治疗失败的多发性骨髓瘤(MM)患者。2022年11月,GSK宣布基于确证性III期临床DREAMM-3研究的失败,已应美国FDA的要求,启动了撤销Blenrep美国上市许可的程序。
DREAMM-3试验研究对比了Blenrep单药与泊马度胺联合低剂量地塞米松(PomDex)的疗效。结果显示:Blenrep组比对照组的中位无进展生存期(mPFS)分别为11.2个月和7个月,虽然Blenrep组更长,但不显著。Blenrep组与对照组ORR分别为41%和36%,12个月DoR率分别为76.8%和48.4%,中位DoR未达到,安全性方面与此前报告一致。在这项临床研究中,GSK采用了无进展生存期(PFS)为替代性终点,但仍未达到研究终点。
R/RMM二线及后线治疗迎转折,Blenrep组合疗法与标准组合疗法相比,mPFS提高近两倍。2023年11月,GSK宣布Blenrep(Belantamabmafodotin)二线及之后治疗R/RMM的III期临床DREAMM-7试验的中期分析结果,mPFS36.6mvs13.4m(HR:0.41),OS趋势显示死亡风险降低了43%(HR:0.57).
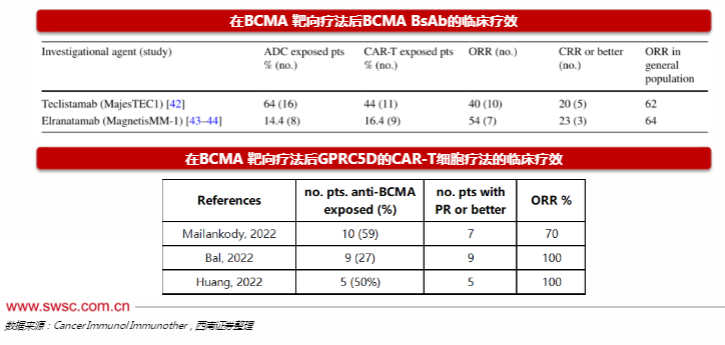
BCMA靶向治疗复发后,BCMA双抗、GPRC5DCAR-T/双抗的疗效更优。
在MajesTEC-1cohortC所报道,已经接受过BCMAADC或BCMACAR-T治疗后的复发患者中,使用Teclistamab的ORR分别为38%和45%。
Elranatamab的MagnetisMM-1研究中,有22%的受试者接受过BCMA靶向治疗,先前接受过BCMA靶向治疗的患者群体(7/13名患者)的ORR为54%。
GPRC5DCAR-T在已经接受过BCMA靶向治疗的人群显示了极佳的临床效果,ORR结果与总体人群无异。
GPRC5D双抗也取得了优异的数据。在MonumenTAL-1中,之前未接受BCMA靶向疗法患者的ORR为71.7%,之前已接受过BCMABsAb治疗或BCMACAR-T的患者的ORR为64.7%。Forimtamig治疗BCMA疗法耐药的患者实现55.6%的ORR。
4.4 二线治疗MM临床数据:有效性
西达基奥仑赛也成为全球首个且唯一获批多发性骨髓瘤二线治疗的CAR-T产品。2024年4月,FDA批准CARVYKTI®(西达基奥仑赛)用于治疗既往至少接受过一线治疗(包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)且对来那度胺耐药)的RR/MM患者。
Blenrep组合疗法与标准组合疗法相比,mPFS提高近两倍。2023年11月,GSK宣布Blenrep(Belantamabmafodotin)二线及之后治疗R/RMM的III期临床DREAMM-7试验的中期分析结果,mPFS36.6mvs13.4m(HR:0.41),OS趋势显示死亡风险降低了43%(HR:0.57)。
西达基奥仑赛2L治疗MM适应症的≥3级CRS发生率相比于末线临床更高,其他安全性相较于末线临床较为一致。
Blenrep治疗的副作用主要为与眼部相关的副作用,通常是可逆的,可以通过调整剂量加以控制。因眼部相关的副作用导致治疗中断的比例较低(9%)。34%接受Blenrep联合疗法的患者出现了3级或以上眼部不良反应,主要包括视力模糊(22%)、干眼症(7%)、眼部刺激(5%)和视力障碍(5%)。82名患者(34%)在基线时至少一只眼睛的最佳矫正视力(BCVA)为20/25或更佳,但其双眼视力恶化至20/50或更差。在进行分析时,几乎所有这些患者(98%)的不良反应都已缓解。不良反应的中位缓解用时为22天。
4.5 一线治疗新诊断MM临床数据:安全性
BCMACAR-T伊基奥仑赛和CD19/BCMACAR-TGC012F的≥3级CRS和ICANS发生率均为0,暂未有导致死亡的TRAE发生,展现了优异的安全性。
GC012F是亘喜生物核心产品,2023年12月被AZ收购,总交易金额12亿美元。2023年12月,AZ宣布收购亘喜生物,对价包括约10亿美元现金(相当于每股ADS10美元)+或有价值权益(CVR)约2亿美元(相当于每股ADS1.5美元),CVR条件包括核心管线GC-012F在2028年底获得FDA的加速批准或在2029年底前获得完全批准,交易总金额高达12亿美元。
GC012F正是基于FasTCAR技术平台开发的核心产品,同时通过BCMA/CD19双靶点的结合,可以覆盖更多患者,并减少了逃逸复发风险。
FasTCAR保留了高比例的年轻态Tscm细胞,细胞干性的增强显著改善了CAR-T的持久性,同时可以用更低的剂量达到更好的治疗效果。也是因为如此,提高疗效的同时也显著地改善了安全性。横向比较,GC012F的剂量水平一般都是105级别,相较于其他的一些疗法,普遍都是106级别的给药剂量。