2024年中国创新药行业ASCO大会专题报告
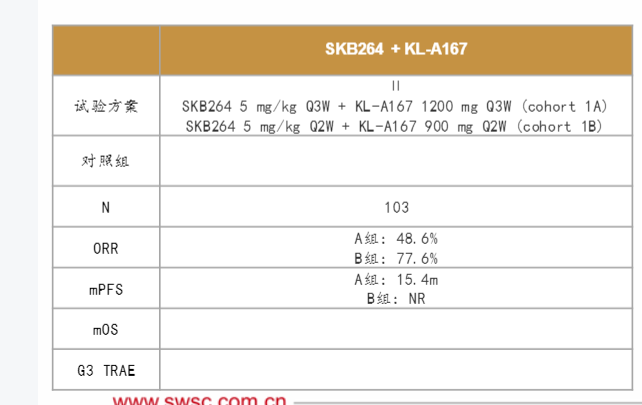
科伦博泰:SKB264+PD-L1一线NSCLC
未曾接受过治疗的晚期无驱动基因突变NSCLC患者入组并按非随机方式每3周接受一次5mg/kg剂量的芦康沙妥珠单抗(sac-TMT)加每3周接受一次1200mg剂量的KL-A167治疗(1A队列)或每2周接受一次5mg/kg剂量的芦康沙妥珠单抗(sac-TMT)加每2周接受一次900mg剂量的KL-A167治疗(1B队列),直至疾病进展或发生不可耐受毒性。截至2024年1月2日,1A队 列和1B队 列分 别入 组40名及63名 患者。中 位年 龄为63/63岁(1A/1B队列);97.5%/85.7%患者的美国东部肿瘤协作组体能状态(ECOGPS)评分为1分;根据IHC22C3pharmDx测定法,分别有30.0%/33.3%、32.5%/30.2%及37.5%/36.5%的患者肿瘤细胞的程序性死亡配体1(PD-L1)表达为<1%、1%-49%及≥50%。1A队列经过为期14.0个月的中位随访后,ORR为48.6%(18/37,2例待确认),疾病控制率(DCR)为94.6%,中位PFS为15.4个月(95%CI:6.7,NE),6个月PFS率为69.2%。B队列经过为期6.9个月的中位随访后,ORR为77.6%(45/58,5例待确认),DCR为100%,未达到中位PFS,6个月的中位PFS率为84.6%。
科伦博泰:末线TNBC
默沙东(MSD)与 科伦博泰(Kelun-Biotech)所联 合开发的TROP2靶向 抗体偶联药 物(ADC)sacituzumabtirumotecan(SKB264/MK-2870)在治疗经治晚期三阴性乳腺癌(TNBC)的一项3期试验当中展现亮眼结果。分析显示,接受SKB264单药治疗的TROP2高表达患者的无进展生存期(PFS)是化疗组患者的3倍以上。截至2023年6月21日的中期分析结果显示,试验达到PFS的主要终点。
SKB264组患者的疾病进展或死亡风险降低69%(HR=0.31,95%CI:0.22-0.45,P<0.00001)。由BICR评估SKB264组的中位PFS为5.7个月(95%CI:4.3-7.2),化疗组患者的中位PFS则为2.3个月(95%CI:1.6-2.7),其中SKB264组与化疗组患者的6个月无进展生存率分别为43.4%与11.1%。针对肿瘤TROP2表达H评分>200患者的亚组分析显示,SKB264组的中位PFS为5.8个月,是化疗组患者(1.9个月)的3倍以上(HR=0.28,95%CI:0.17-0.48)。
截至2023年11月30日,针对患者总生存期(OS)的首次预定中期分析显示,在中位随访10.4个月期间,SKB264组的OS具有统计学显著优势(HR=0.53;95%CI:0.36-0.78;P=0.0005)。SKB264组的中位OS尚未达到(95%CI:11.2-NE),化疗组的中位OS为9.4个月(95%CI:8.5-11.7)。BICR评估SKB264组的客观缓解率(ORR)为43.8%,化疗组则为12.8%。
荣昌生物:RC48+PD-1+S-1 一线HER2+胃癌
维迪西妥单抗(RC48)联合替雷利珠单抗和S-1用于HER2过表达晚期胃或胃食管交界腺癌一线治疗的疗效:一项多中心、单臂、II期试验(RCTS)从8个中心共入选47例患者,中位年龄65岁(39~81岁),37例男性,37例GC患者和8例GEJC患者,均为腺癌。其中,30例(63.8%)为HER2IHC3+,11例(23.4%)为HER2IHC2+/FISH+,6例(12.8%)为IHC2+/FISH-。PD-L1CPS≥5和≥1的患者分别占14.9%和36.2%。中位随访时间为116.5天,患者接受了5.0(中位数)个治疗周期的治疗。截至2024年1月20日,40例患者进行了疗效分析,44例患者进行了安全性分析。
ORR达到95.0%(38/40,95%CI:83.1-99.4%),临床完全缓解率为20.0%(5/40,95%CI:4.2-26.8%),DCR为100.0%(95%CI:91.2-100.0%)。中位PFS和OS尚未达到,但6个月和9个月的PFS率分别为100.0%和80.8%,6个月和9个月的OS率分别为100.0%和83.8%。HER2IHC3+组、IHC2+/FISH+组和IHC2+/FISH-组的ORR之间没有显著差异(分别为93.3%、100.0%、100.0%)。CPS≥1或<1的患者ORR分别为100.0%和92.9%。一例IVA期GC患者(cT4bN3M0,HER23+,CPS0)和另一例IVB期GEJC患者(cT3N2M1,HER22+/FISH+,CPS≥5)接受了根治性手术,均达到了病理完全缓解。40.9%的患者发生3/4级治疗相关不良事件,主要是中性粒细胞减少、疲劳和腹泻。
乐普生物:TF ADC,四线胰腺癌
组织因子(“TF”)过度 表 达 与 宫颈 癌(“CC”)及胰腺癌(“PC”)等 实 瘤 的血 栓 形 成、转 移 及 不良 预 后 有 关。MRG004A是一种TF靶点特异性偶联的创新ADC药物。将于2024年ASCO年会上口头报告MRG004A治疗晚期实体瘤患者的I/II期研究的安全性及初步疗效结果,概述如下:截至投稿日,63名患者已入组,其中43名患者处于剂量递增阶段(介于0.3至2.6mg/kg的8个剂量水平),20名患者处于剂量扩展阶段(15名患者为2.0mg/kg,5名患者为2.4mg/kg)。MRG004A在胰腺癌患者中观察到显著抗肿瘤活性。在2.0mg/kg剂量组的12名既往已接受中位3线治疗的可评估PC患者中,有4例部分缓解(“PR”)及6例 病情稳定(“SD”),客观缓解率(“ORR”)为33.3%(4/12),疾病控 制率(“DCR”)为83.3%(10/12)。其中,5名患者为TF高表达(TF≥50%)且先前已接受2线或以下治疗的亚组中,4名患者达到PR,1名患者达到SD。TF高表达的ORR为80%(4/5),DCR为100%(5/5)。
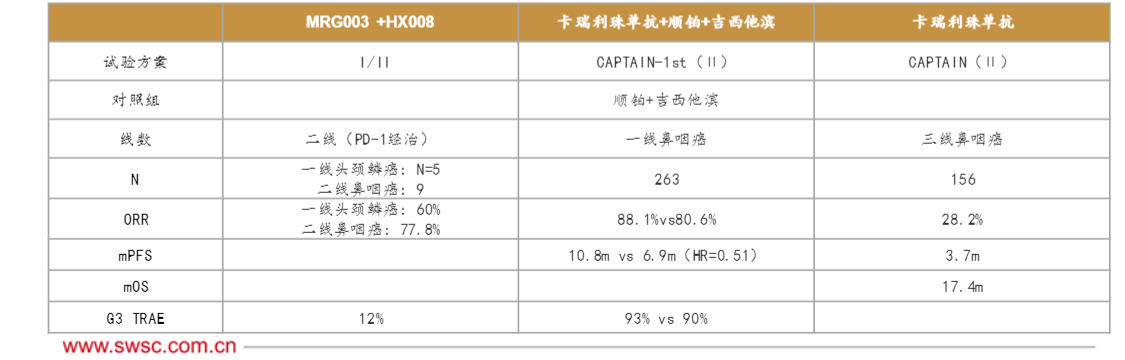
乐普生物:EGFR ADC,二线鼻咽癌
普特利单抗(HX008)是一种于中国获准上市的重组人源化PD-1抑制剂,而MRG003是一种EGFR-ADC,在头颈部鳞状细胞癌(“SCCHN”)和鼻咽癌(“NPC”)的多项临床研究中显示出良好的抗肿瘤活性。在临床前研究中,联合疗法已显示出协同抗肿瘤作用。该研究旨在评估联合疗法对EGFR表达的局部晚期或转移性实体瘤患者的安全性和有效性。我们已观察到良好的初步数据,并获2024年ASCO年会口头报告。截至2024年1月30日,33名患者(I期:9名NPC、1名SCCHN及3名其他实体瘤患者,II期:14名NPC及6名SCCHN患者)已入组,中位年龄为52岁,其中25名患者为男性。
在27名可评估患者中,17名患者达到PR,7名患者达到SD,ORR和DCR分别为63.0%(95%置信区间为42.4至80.6)及88.9%(95%置信区间为70.8至97.7)。在II期临床9名可评估的接受PD-1加铂类化疗的一线治疗后EGFR阳性NPC患者中,观察到2名患者达到完全缓解(“CR”),5名患者达到PR及2名患者达到SD,ORR及DCR分别为77.8%(95%置信区间为40.0至97.2)及100%(95%置信区间为66.4至100)。5名可评估的未接受过系统治疗的EGFR阳性SCCHN患者中观察到3名患者达到PR及1名患者达到SD,ORR及DCR分别为60%(95%置信区间为14.7至94.7)及80%(95%置信区间为28.4至99.5)。
研究中的缓解持续时间(“DOR”)及无进展生存期(“PFS”)尚不成熟。接受治疗时间最长的患者的DOR超过17个月,且治疗仍在持续。4名患者发生3-4级常见治疗相关不良事件(“TRAE”),主要包括白细胞数量减少(9%)及低钾血症(6%)。
和黄医药:呋喹替尼+PD-1 末线CRC
呋喹替尼联合替雷利珠单和立体定向消融放疗最新结果立体定向消融放疗(SABR)可通过诱导免疫原性死亡和重塑肿瘤免疫微环境来增加免疫治疗的敏感性。此外,抗血管生成治疗通过其对≥3线mCRC患者的免疫调节作用,显示出与程序性死亡受体1或其配体1(PD-1/L1)抑制剂的协同抗肿瘤作用。一项单臂、前瞻性的II期RIFLE研究[5],旨在评估呋喹替尼联合替雷利珠单抗和SABR治疗mCRC患者的疗效和安全性。在31例可评疗效的患者中,1例达CR,8例达部分缓解(PR),14例达疾病稳定(SD),ORR和DCR分别为29%和74.2%,中位PFS为8.8个月(95%CI5.868-11.732)且安全性良好。上述结果提示,呋喹替尼联合免疫治疗和放疗治疗mCRC患者疗效颇具前景,有望为mCRC患者提供新的治疗策略。
和黄医药:呋喹替尼+TAS-102 末线CRC
呋喹替尼联合TAS-102三线治疗结果一项开放标签、单臂、多中心II期研究,旨在评估呋喹替尼联合TAS-102三线治疗mCRC患者的疗效和安全性。研究纳入50例患者,截至2024年1月10日,46例患者可评估疗效,其中5例患者达PR(5/46例,10.9%),29例患者达SD(29/46例,63.0%),中位PFS为6.46个月(95%CI4.20-8.62),治疗相关不良事件(TRAEs)一般可控且可耐受。上述初步结果表明,呋喹替尼联合TAS-102作为mCRC患者的三线治疗具有令人鼓舞的临床活性且耐受性良好,期待未来OS数据。
呋喹替尼联合信迪利单抗治疗经治pMMR晚期EMC的II期研究截至2023年11月15日,研究纳入98例经治pMMREMC患者,中位随访时间为15.7个月,87例患者可评估疗效,独立评审委员会(IRC)评估的ORR和DCR分别为35.6%和88.5%,总体患者的中位PFS和OS分别为9.5个月和21.3个月。
5月23日,首药控股完全自主研发的选择性RET酪氨酸激酶抑制 剂SY-5007在非小细胞肺癌中的关键临床II期(NCT05278364)的初步研究结果以摘要和壁报的形式在2024年度美国临床肿瘤学会(ASCO)上公布。该关键临床II期研究由上海市肺科医院周彩存教授牵头,为一项开放标签、多中心研究。截至2024年1月16日,共入组105例RET融合阳性非小细胞肺癌患者,其中56例为初治患者,49例为既往接受过铂类化疗或免疫疗法等系统性治疗的经治患者,所有患者的中位随访时间为4.57个月(95%置信区间[CI]0.2-10.3)。盲态独立中心评估(BICR)的所有患者总体客观缓解率(ORR)为77.1%(95%CI67.9-84.8),其中,初治患者的ORR为82.1%(95%CI69.6-91.1),经治患者的ORR为71.4%(95%CI56.7-83.4)。
对于基线具有颅内可测量靶病灶的患者,经研究者评估的颅内ORR为80.0%(95%CI44.4-97.5)。患者的中位缓解持续时间(DoR)、中位无进展生存期(PFS)和总生存期(OS)尚未达到。在安全性和耐受性方面,96.2%的患者发生了治疗相关不良事件(TRAE),42.9%的患者发生了≥3级TRAE。最常见的TRAE包括 天冬氨酸氨基转移 酶升高(57.1%)、丙氨酸氨基 转移酶升高(56.2%)、腹泻(55.2%)和高 血压(41.9%)等。最常见的≥3级TRAE为高血压(15.2%)、丙氨酸氨基转移酶升高(5.7%)和中性粒细胞计数减少(5.7%)等。TRAE导致的剂量中断和降低发生比例分别为39.0%和23.8%。1.9%的患者因TRAE永久停药,没有治疗相关死亡发生。

信达生物:IBI389:三线胰腺癌
IBI389(抗CLDN18.2/CD3双特异性抗体)在晚期胰腺导管腺癌患者中的安全性和有效性:I期研究的初步结果纳入了符合条件的CLDN18.2阳性的局部晚期、难治性或转移性PDAC患者,这些患者对标准治疗失败或不能耐受。IBI389单药治疗在剂量递增和扩展的两阶段研究中,按6个剂量水平(5-600mg/kg,每三周一次或每两周一次)静脉注射。在剂量≥30mg/kg时,采用了先导剂量3至10mg/kg的逐步剂量递增策略。主要目标是评估安全性,次要目标是根据RECISTv1.1标准由研究者评估的有效性,包括客观缓解率(ORR)和疾病控制率(DCR)。截至2024年1月9日,共有64名CLDN18.2阳性的PDAC患者被纳入(男性:64.1%,女性:35.9%,中位年龄:60.0岁,IV期:84.4%)。所有患者均接受过先前治疗,中位治疗线数为2(范围:1至5)。62名(96.9%)患者出现了治疗相关不良事件(TRAEs),其中35名(54.7%)患者出现了3级或以上的TRAEs。
最常见的3级或以上TRAEs(≥5%)包括γ-谷氨酰转移酶升高(20.3%)、淋巴细胞计数减少(9.4%)和恶心(7.8%)。33名(51.6%)患者出现了细胞因子释放综合征(CRS)相关不良事件,未见3级或以上的CRS。24名(37.5%)患者出现了导致剂量中断的TEAEs,3名(4.7%)患者出现了导致治疗中止的TEAEs。在CLDN18.2表达≥10%(免疫组化2+/3+)的患者中观察到了IBI389的初步疗效(600mg/kg)。截至2024年1月31日,共有23名患者可评估疗效,其中7名患者部分缓解(PR),9名患者疾病稳定(SD)。ORR为30.4%(95%CI:13.2-52.9),DCR为69.6%(95%CI:47.1-86.8)。
反应持续时间(DoR)和无进展生存期(PFS)的中位数尚未达到。将在会议上呈现更多关于安全性和有效性的更新数据。
信达生物:IBI343(抗Claudin18.2抗体药物偶联物):三线胰腺癌
符合条件的患者为对标准治疗失败或无法耐受的患者。IBI343以6mg/kg或8mg/kg每三周(Q3W)静脉注射。在剂量递增阶段,无论CLDN18.2表达情况如何,患者均可入组。在剂量扩展阶段,要求患者CLDN18.2表达≥40%(免疫组化1+/2+/3+染色强度)。主要终点是安全性。次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)和无进展生存期(PFS),由研究者根据RECISTv1.1标准评估。截至2023年12月19日,共有35名患者(剂量递增阶段1名,剂量扩展阶段34名)来自中国和澳大利亚(男性:57.1%,中位年龄:58.0岁,ECOGPS1:71.4%,IV期:91.4%,先前治疗的中位线数为2线,包括28名PDAC患者和7名BTC患者。患者接受了6mg/kg(n=17)或8mg/kg(n=18)的IBI343治疗。中位治疗持续时间为7.0周(范围:3.0-23.6周),其中23名(65.7%)患者仍在接受治疗。所有患者中,28名(80.0%)出现了治疗相关不良事件(TRAEs),其中9名(25.7%)出现了3级或更高级别的TRAEs。常见的TRAEs(≥20%)包括贫血(42.9%)、中性粒细胞计数减少(28.6%)、恶心(25.7%)、呕吐(25.7%)和白细胞计数减 少(22.9%)。'
4名(11.4%)患者发生了严重的TRAEs。导致剂量中断和治疗中止的TRAEs分别发生在7名(20.0%)和1名(2.9%)患者中。没有患者因TRAEs导致死亡。IBI343在PDAC和BTC患者中的安全性与整个研究队列相似,未观察到新的安全信号。截至2024年1月15日,25名接受6mg/kg和8mg/kg剂量的患者可进行疗效评估。7名患者(5名PDAC和2名BTC)出现了部分缓解(PR),ORR为28.0%(95%CI:12.1-49.4),DCR为80.0%(95%CI:59.3-93.2)。在接受6mg/kg且CLDN18.2表达≥60%(1+/2+/3+,n=13)的可评估患者中,5名患者出现PR,ORR为38.5%(95%CI:13.9-68.4),DCR为84.6%(95%CI:54.6-98.1)。在这一亚组的10名PDAC患者中,ORR为40%(95%CI:12.2-73.8)。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)