2024乙肝治疗药物市场前景分析报告
国内慢乙肝疾病负担沉重,存量患者数量巨大
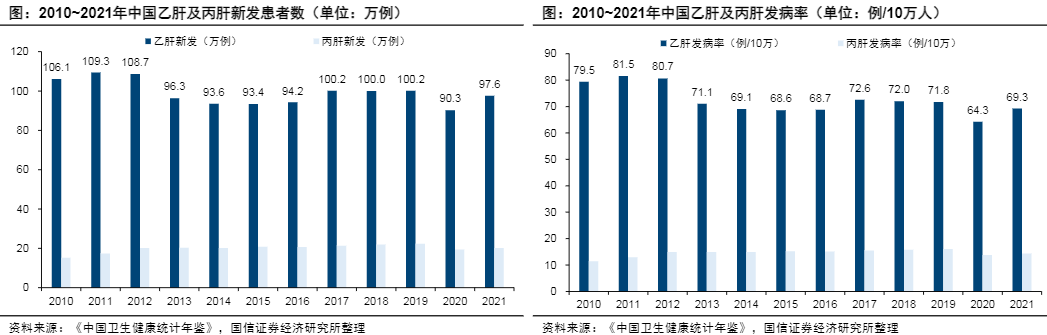
流行病学:中国是全球乙型肝炎负担最大的国家
根据WHO数据,2019年全球约有3.16亿慢性乙型肝炎(chronichepatitisB,CHB)感染者,82万人死于乙型肝炎病毒(hepatitisBvirus,HBV)感染所致肝硬化、肝细胞癌(hepatocellularcarcinoma,HCC)或肝衰竭等相关疾病。我国是全球乙型肝炎负担最大的国家,根据PolarisObservatoryCollaborators数据,2022年我国一般人群HBsAg流行率为5.6%,HBV感染者达到7974万人,其中CHB患者~3000万人;根据《中国卫生健康统计年鉴》,近年我国乙肝新发患者数达到90~100万例/年,发病率达到70~80例/10万人。
乙肝疫苗普及,儿童及青少年发病率低。我国于1992年在全国范围内推广乙肝疫苗接种工作,2002年正式将乙肝疫苗纳入全国儿童计划免疫,并大规模普及;2014年,中国疾控中心对全国1~29岁人群乙肝血清流行病学调查显示,1~4岁、5~14岁及15~29岁人群HBsAg流行率分别为0.32%/0.94%/4.38%,较1992年水平分别下降96.7%/91.2%/55.1%。
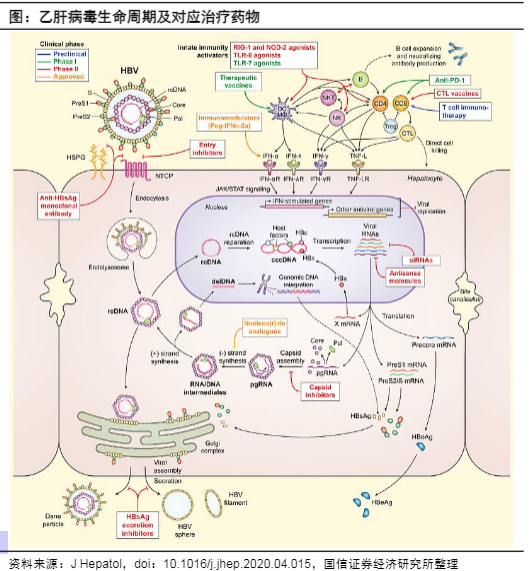
病原学:HBV生命周期复杂,在研乙肝药物百花齐放
HBV属嗜肝DNA病毒科,基因组长约3.2kb,为部分双链环状DNA,编码HBsAg、HBcAg(乙肝核心抗原)、HBeAg(乙肝E抗原)、病毒聚合酶和HBx蛋白。
HBV通过肝细胞膜上的钠离子-牛磺胆酸-协同转运蛋白(sodiumtaurocholatecotransportingpolypeptide,NTCP)作为受体进入肝细胞。在细胞核内以负链DNA为模板形成cccDNA(共价闭合环状DNA),以cccDNA为模板转录而成的前基因组RNA(pregenomeRNA,pgRNA)可释放入外周血,血清HBVRNA被认为与肝细胞内cccDNA转录活性相关。HBV可整合至宿主肝细胞基因组中(intDNA),HBV整合被认为与HBsAg持续表达和HCC发生等密切相关。
目前已上市及在研乙肝药物开发策略主要包括:•靶向HBV生命周期:核苷类似物(抑制HBV复制)、进入抑制剂(竞争性结合NTCP,阻止HBV进入细胞,从而防止肝细胞感染)、siRNA/ASO、衣壳抑制剂(诱导形成异常/空核衣壳)、HBsAg抑制剂(降低血清HBsAg水平);•靶向宿主免疫系统:长效干扰素、CPI、TLR激动剂、治疗性疫苗。
慢性HBV感染的发病机制复杂,HBV不直接破坏肝细胞,病毒引起的免疫应答是导致肝细胞损伤及炎症坏死的主要机制,而炎症坏死持续存在或反复出现是慢性HBV感染者进展为肝硬化甚至HCC的重要因素。
据统计,未经抗病毒治疗CHB患者的肝硬化年发生率为2%~10%,代偿期肝硬化进展为失代偿期的年发生率为3%~5%,失代偿期肝硬化的5年生存率为14%~35%;肝硬化患者HCC年发生率为3%~6%(非肝硬化HBV感染者的HCC年发生率为0.2%~1.0%)。2022年我国原发性肝癌发病人数达到36.8万人,其中86%感染了乙肝病毒,6.7%为乙肝/丙肝病毒合并感染。
根据PolarisObservatoryCollaborators数据,2022年中国仅有~1900万(24%)的乙肝患者得到确诊,而符合治疗条件的有~3300万人,但其中仅有~500万人(占符合治疗条件人数的15%)接受了抗病毒治疗。2023年11月,国家卫生健康委医院管理研究所面向全国启动“乙肝临床治愈门诊规范化建设与能力提升项目”,该项目旨在更好地推动全国各级医疗卫生机构开展设立的“乙肝临床治愈门诊”规范化建设与管理。
现阶段CHB的治疗目标是最大限度的长期抑制HBV复制,减轻肝细胞炎症坏死及肝脏纤维组织增生,延缓和减少肝功能衰竭、肝硬化失代偿、HCC和其他并发症的发生,改善患者生命质量,延长其生存时间。对部分适合条件的患者,应追求临床治愈(功能性治愈)。
完全治愈(病毒学治愈):血清HBsAg检测不到,肝内和血清HBVDNA清除(包括肝内cccDNA和整合HBVDNA),血清抗-HBc持续阳性,伴或不伴抗-HBs出现;•临床治愈(功能性/免疫学治愈):血清HBsAg消失,且在停止治疗后24周时使用常规检测方法检测不到HBsAg(检测下限0.05IU/mL)且HBVDNA低于LLOQ(lowerlimitofquantification,最低可定量浓度),HBeAg阴转,伴或不伴HBsAg血清学转换(指HBsAg转阴且抗-HBs转阳),残留cccDNA可持续存在,肝脏炎症缓解和肝组织病理学改善,终末期肝病发生率显著降低。

短期:NAs经治“优势人群”可通过PEG IFNα治疗获益
2.1 NAs:单药可获得持续生化/病毒学应答,但难以实现功能性治愈
核苷(酸)类药物(Nucleos(t)ideAnalogue,NAs)为CHB一线用药,根据《慢性乙型肝炎临床治愈(功能性治愈)专家共识》,NAs使用方便且耐受性良好,目前约有80%以上接受抗病毒治疗的患者应用NAs治疗,2022版指南推荐CHB患者首选NAs(恩替卡韦、富马酸替诺福韦酯、富马酸丙酚替诺福韦、艾米替诺福韦)治疗。NAs单药可强效抑制HBV复制,但无法直接抑制cccDNA的转录活性,从而无法有效抑制病毒蛋白如HBsAg的表达,NAs治疗难以获得持久的免疫学控制,停药后复发率高,患者需要长期/终身用药。
2.2 PEG IFNα:曾经的HCV标准疗法,乙肝功能性治愈再起航
干扰素(IFN)是一种广谱抗病毒剂,其不直接杀伤或抑制病毒,而是通过激活宿主免疫细胞、促进细胞因子表达及诱导干扰素刺激基因并经干扰素通路编码多种抗病毒蛋白,从而发挥免疫调节和抗病毒作用;此外,干扰素也可通过抑制HBV转录、增强pgRNA和核心颗粒降解或调控cccDNA表观遗传学修饰等方式减少病毒抗原产生。
普通干扰素半衰期较短(一周3次或隔日1次给药),通过偶联聚乙二醇(PEG)以延长其半衰期(一周1次给药),Schering-Plough(2009年被Merck收购)于2000年推出全球首个12KDaPEGIFNα-2b产品佩乐能(PEGINTRON),Roche于2002年上市40KDaPEGIFNα-2a产品派罗欣(PEGASYS)。
普通干扰素发现之初主要以单药或联用利巴韦林的方式(PR方案)治疗HCV(丙型肝炎);长效干扰素问世后,凭借更好的疗效及依从性迅速取代短效干扰素成为HCV的标准疗法;2010年后,随着以索磷布韦为代表的直接抗病毒药物上市,HCV治疗率进入“90%+”时代,PEGIFNα产品全球销售额快速下滑,2017年后基本退出市场。
“中国慢乙肝临床治愈(珠峰)工程项目”于2018年启动,是全球样本量最大的CHB临床治愈真实世界研究。纳入患者标准为NAs经治≥1年,HBVDNA<100IU/mL,HBeAg阴性且HBsAg≤1500IU/mL的CHB患者(优势人群),根据患者意愿接受PEGIFNα单药或PEGIFNα联合NAs治疗48周,主要疗效指标为48周的HBsAg清除率。截至2024年3月,项目已入组患者超3万例,临床治愈患者超过6000例。
根据2022年“珠峰项目”3.5年阶段性数据,阶段性分析纳入完成48周治疗的患者数据,其中3988例纳入PP分析,患者基线HBsAg水平为381IU/mL;第12/24/36/48周HBsAg清除率分别为9.5%/22.0%/29.0%/33.2%,对于基线HBsAg≤100IU/mL患者48周清除率可达到56%;共计1006例患者(68.4%)第48周时达到HBsAg≤100IU/mL。
根据“绿洲”项目进行1.5年的阶段性数据,对于CHB高基线人群,无论经治或初治,基线HBsAg水平较高的患者接受不同方案的48周临床治愈率都非常低,但基线HBsAg水平较高的患者接受48周PEGIFNα治疗后有40%以上可降至较低的HBsAg水平。在PEGIFNα经治患者中,基线时HBsAg≤1500IU/mL的患者有17.1%在接受新一轮PEGIFNα治疗48周后可实现HBsAg清除,基线时HBsAg≤200IU/mL的患者有24.5%在接受新一轮PEGIFNα治疗48周后可实现HBsAg清除。
因此,对于HBsAg水平较高的患者,虽然PEGIFNα治疗48周后仍难以实现功能性治愈,但PEGIFNα经治后达到较低HBsAg水平的患者,可能通过接受新一轮PEGIFNα治疗48周后实现功能性治愈。
国内一般人群慢性HBV感染人数约为8000万,推算出非活动性HBsAg携带状态(IHCs)人群约为3000万,与CHB患者人数相当。2022版指南对IHCs人群的定义进行了更新:1)IHCs人群:血清HBsAg阳性(<1000IU/mL)、HBeAg阴性、抗-Hbe阳性,HBVDNA阴性(<20IU/mL),ALT/AST持续正常(1年内连续随访3次以上,每次至少间隔3个月),并且尚不推荐治疗;2)不确定期人群:其他条件相同,HBVDNA阳性(<2000IU/mL),推荐抗病毒治疗。然而,对既往初诊为IHCs的患者进行肝活检发现,25%~62%的患者存在明显的肝脏炎症(G2~G3)或肝纤维化(S2~S3),~10%左右患者有肝硬化,IHCs人群疾病进展及肝癌发生风险均较高。
“星光计划”于2022年6月启动,是全球首个针对IHCs人群的临床治愈计划,预计入组1.5万人。截至2023年11月,已完成入组5790例患者,整体HBsAg基线为220IU/mL,其中<100IU/mL占比超过一半,平均ALT水平为22U/L,其中低水平比例为75%。PP分析IHC人群基于PEGIFNα治疗12/24/36周HBsAg清除率分别达到14%/26%/27%,36周累积HBsAg清除率达到53%。
国内共有3款长效干扰素产品获批上市,其中Merck/先灵葆雅的佩乐能(2016年2月起停产)、Roche的派罗欣(国内合作方歌礼制药于2022年底停止提供推广服务,Roche将不再寻求其他合作方,也不会在国内继续开展派罗欣的商业推广)已退出中国市场,短期内派格宾为国内市场唯一长效干扰素产品。
派格宾是全球首个40kD聚乙二醇干扰素α-2b注射液,于2016年在国内获批上市。基于抑制病毒复制和增强免疫的双重作用,派格宾获批适应症为慢性乙型/丙型肝炎(180μg剂量qWx48);2024年3月,新增联合核苷(酸)类似物适用于临床治愈成人慢性乙型肝炎适应症申请获受理。
在研管线方面,凯因科技的长效干扰素产品派益生丙肝适应症于2018年获批上市,乙肝适应症Ph3临床于2021年12月完成首例受试者入组,主要终点为第72周血清HBsAg消失率(HBsAg低于定量检测下限LLOQ0.05IU/mL),NDA申请提交准备中。
用药人群:根据PolarisObservatoryCollaborators数据,2022年中国仅有~1900万(24%)的乙肝患者得到确诊,而符合治疗条件的有~3300万人,但其中仅有~500万人(占符合治疗条件人数的15%)接受了抗病毒治疗;根据《中国卫生健康统计年鉴》,近年我国乙肝新发患者数达到~100万例/年,假设新患使用抗病毒药物治疗率为15%,并且治疗率逐年增长;•用药费用:根据《干扰素省际联盟集中带量采购公告(第1号)》,长效干扰素产品中选价格为667元/支,一个疗程用药48周,并且考虑到部分慈善赠药及患者脱落等因素,目前年用药费用约为3万元,假设每两年降价10%;•渗透率:NAs经治HBsAg基线<100、100~500、500~1000及1000~1500IU/mL的患者占比分别约为25%/20%/10%/5%,中性假设下对应HBsAg基线人群的远期累计治疗率分别为60%/40%/15%/10%,则对应全部抗病毒药物用药人群渗透率~25%。
长期:以小核酸药物为基石,多药物联用冲击功能性治愈
3.1 siRNA/ASO:以小核酸药物为基石多药联用
以siRNA/ASO为代表的小核酸药物,通过靶向HBV保守的x基因(HBx,位于转录整合热点上游),从而抑制intDNA及cccDNA产生新的HBsAg,同时也能够下调全部4种HBV转录本(Pol、S、core及X)。•小核酸±NAs:JNJ-3989、RG6346、VIR-2218单药或联用NAs治疗48周后HBsAg清除率分别为3%/7%/0%,但治疗结束时HBsAg较基线变化较大,如JNJ-3989用药48周后HBsAg平均下降2.6log10IU/mL。
小核酸序贯/联用PEGIFNα:现阶段对HBsAg高基线人群治疗效果最好的组合疗法,VIR-2218、RG6346联用PEGIFNα用药48周后HBsAg清除率分别为31%/30%,停药24周后仍有15%/23%清除率。•小核酸+抗体±PEGIFNα:在MARCH研究中,VIR-2218+VIR-3434±PEGIFNα治疗24周实现15%/14%的HBsAg清除率,较VIR-2218+PEGIFNα24周疗效进一步提升;VIR-2218+VIR-3434±PEGIFNα治疗48周EoT以及停药后24周数据将分别于2024Q4及2025Q2读出。
3.2 HBsAg抗体:可快速降低血液中HBsAg水平,缓解免疫抑制/耗竭
HBsAg抗体通过直接靶向HBV表面抗原,从而实现:1)中和病毒并阻止其进入肝细胞;2)清除血液中HBsAg抗原并呈递至APC(antigen-presentingcells,抗原呈递细胞);3)激活T细胞(vaccinaleffect,疫苗效应)。
在MARCH研究中,对于NAs经治获得病毒学影响且HBsAg<3000IU/mL的患者,大多数患者(10/16)在首次用药7天内HBsAg下降≥1log10IU/mL,即单剂次小剂量的VIR-3434可快速降低血液中HBsAg水平,从而解除HBsAg对人体免疫系统的抑制和耗竭作用。
3.3 CpAMs:可高效实现HBVDNA清除,对HBsAg影响有限
核心蛋白变构调节剂/衣壳组装调节剂(coreproteinallostericmodulators,CpAMs)通过与HBV核心二聚体结合,干扰衣壳组装并破坏pgRNA的封装以及HBVDNA的复制,从而抑制病毒的产生。CpAMs对pgRNA和HBVDNA的清除效果较好,但对于细胞核内已存在的cccDNA及其转录本的含量没有影响,因此难以实现HBsAg的清除,并且停药后pgRNA容易出现反弹。
NTCP是肝细胞表面蛋白,正常生理功能为运输胆汁酸,HBV表面蛋白Pre-S1结构域通过结合NTCP介导病毒入侵、感染宿主细胞过程。目前HBV进入抑制剂药物设计思路主要为酰化Pre-S1多肽竞争性结合NTCP受体,也有抗体药物通过直接靶向Pre-S1从而阻断HBV进入肝细胞。但与CpAMs类似,进入抑制剂无法影响intDNA及cccDNA,对HBsAg影响有限并且停药后容易复发。
先天免疫系统(innateimmune)是宿主抵御病原微生物入侵的第一道防线,病原体识别受体(PRR)识别病原体相关分子模式(PAMP)并启动天然免疫应答,PRR主要包括TLR(Toll样受体)和视黄酸诱导基因I(RIG-I)样受体(RLR)。
TLR7/8均为跨膜受体,可识别病毒单链RNA,促进天然免疫细胞(以树突状细胞为主)分泌I型IFN、增强肝细胞对HBV抗原肽的抗原呈递功能、促进针对HBV的适应性免疫应答,从而抑制HBV复制;RIG-I与HBVpgRNA的ε茎环结合,诱导肝细胞表达大量III型IFN。
请务必阅读正文之后的免责声明及其项下所有内容3.6 CPI:PD-L1单药在NAs经治HBsAg低基线人群中实现功能性治愈PD-L1在HBV感染的肝脏细胞高表达,造成T细胞功能耗竭,进而导致机体免疫耐受而使HBV感染慢性化。
ASC22(恩沃利单抗)是全球首款皮下注射PD-L1抗体,由康宁杰瑞开发,2019年授予歌礼制药ASC22用于治疗乙肝在内的所有病毒性疾病的开发和商业化的全球独家权益。•Ph2b:在1mg/kgASC22联合NAs(n=48)治疗24周队列中,基线HBsAg≤100IU/mL的患者HBsAg下降更明显,42.9%(3/7)获得HBsAg持续清除(<0.05IU/mL),1例HBsAg消失的患者在最后一次ASC22给药6周后出现HBsAg血清学转换;•Ph2bexpansion:ASC22单药结合NAs背景治疗显示出了统计学意义的HBsAg显著下降,且24周治疗后,21.1%(4/19)的患者实现HBsAg清除。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)