2024医药行业报告:生长激素市场新机遇
1生长激素潜在市场广阔,长效水针降低给药频次
生长激素临床应用主要为治疗矮小症,目前我国接受正规治疗比例较低。根据第七次人口普查数据,按我国需要治疗的4-15岁人群基数及约3%的患病率计算,现存矮小症发病人数约640万。目前病理性矮小症通常可通过皮下注射补充生长激素以进行治疗,这一治疗方法逐渐得到广泛认可和应用。据中华医学会数据显示,矮小症主要人群得到规范化治疗的比例低于5%。
中美获批生长激素适应症存在差异,国内长春高新赛增获批适应症处领先地位。美国FDA批准适应症有11个,目前我国获批的生长激素适应症有12个,其中有10个获批适应症重叠,为儿童生长激素缺乏症,Noonan综合症、SHOX基因缺陷、Prader-Willi综合征(PWS)、特发性身材矮小(ISS)、性腺发育不全(特纳综合症TS)、小于胎龄儿(SGA)、慢性肾脏疾病(CKD)、成人生长激素缺乏症(AGHD)、成人短肠综合症。美国批准的HIV感染相关性衰竭综合症未在我国获批,而我国批准的重度烧伤治疗、软骨发育不全未在美国获批。相较国内其他生长激素产品,长春高新子公司金赛药业产品赛增率先获批12类适应症,目前处于领先地位。
我国存在四种主要矮小症致病因,合计占比约70%。我国矮小症主要致病因为生长 激素缺 乏症(GHD)、特 发性矮 小症(ISS)、小于 胎龄儿 (SGA)和Turner综合征(TS)四种,在导致矮小症各病因占比分别为38.60%、22.02%、7.23%和2.12%,总和占发病人群约70%。根据王丹丹等人《基因重组生长激素的合理应用及规范化治疗》,使用rhGH进行治疗的剂量与多种因素相关,包括病种、性发育状态、体重以及胰岛素样生长因子-1(IGF-1)的水平等。
生产激素产品历经多次迭代,长效水针治疗效果提升。目前生长激素产品处于第五代。有研究表明,患者治疗依从性与治疗效果存在正向关系,即依从性越高,身高改善越有保障。传统产品短效水针、短效粉针使用时需每日注射,患者依从性较低,漏针的几率较大,最终导致身高改善不足。长效生长激素有效解决了患者漏针困局,一周只需注射1次,改变以往的每日注射模式,使得治疗踏入以周计算的时代。因此,长效生长激素大大降低了漏针的可能性,显著地提高患者治疗的依从性,能极大程度地保障治疗效果。
2短效产品集采降价利空出尽,长效产品竞争变中有进
2.1集采缓解治疗费用,国内生长激素现有规模过百亿
多个省份陆续对生长激素短效产品开展集采,集采降价利空基本出尽。2022年3月10日广东联盟双氯芬酸等药品集中带量采购结果公布,2023年1月10日正式实施,采购周期为2年;本次广东集采金赛药业和联合赛尔粉针产品中选,相对最高有效申报价的降幅分别为52.46%和28.98%,安科生物和未名海济的粉针产品备选,且安科生物获得增量使用。2022年11月金赛药业粉针中标福建省带量集采。2022年11月安科生物水针和金赛药业粉针中标河北省集采。此外,在2023年11月17日浙江省第四批集采结果公告中,金赛药业、安科生物的短效水针、短效粉针以及未名海济、联合赛尔的短效粉针中标。
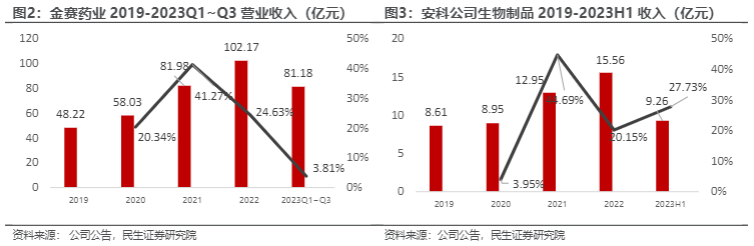
集采降价换销量,金赛药业顺利实现营收增长。长春高新2023年8月公告显示,已经落地实施集采的广东、河南、河北等部分省份,2023上半年集采相关产品收入增幅高于公司整体生产激素产品的收入增幅,基本实现了以价换量的目标。金赛药业2019-2023H1营业收入持续增长,其中2023年上半年长效产品收入增长30%,2023Q2长效产品收入增长70%,目前长效产品在整体收入中的占比进一步提升,占比28%左右。
生物制品业务收入持续增长,安科生物稳健应对集采影响。安科生物2023年4月公告显示,集采执行后公司生长激素水针销售增幅较大,主要是产品具有不含防腐剂的特色受到医患的认可。公司生物制品业务2019-2023H1业务收入保持持续增长态势,且2023Q1-Q3生长激素产品销售收入同比增长28.45%。
2.1.2国内市场规模超百亿,生长激素治疗费用区间大
国内生长激素市场规模增长迅速,现有规模约120亿元。据弗若斯特沙利文统计,中国人生长激素市场规模由2018年的6亿美元(约40亿元人民币)迅速增至2022年的17亿美元(约120亿元人民币),在全球市场中占市率达34%,超过美国成为这一领域第一大用药国。此外,据米内网统计,2022 年中国公立医疗机构终端rhGH销售规模约为67 亿元,其中长效生长激素销售规模已超过7亿元,同比增长33.71%。
1)短效生长激素产品国家医保乙类,缓解患者治疗压力。重组人生长激素医保类型为乙类,并限生长激素缺乏症使用。乙类医保报销比例以及最高限额具体参照各省市医保局相关条款,如陕西咸阳市规定:起付标准360元,报销比例70%或最高限额20000元/年。此外,长效生长激素尚未纳入国家医保范围。
2)长效生长激素治疗费用高于短效生长激素,是市场规模增长的潜力因素之一。由于药效和生产研发成本的差异,加之集采、医保政策的影响,长效生长激素与短效生长激素的治疗费用差异悬殊。以金赛药业的长效和短效产品为例,赛增(短效产品)的广东省平均集采价为7.3元/IU,而金赛增(长效产品)的市面价格约为81元/IU,用药量相同的情况下,两类产品治疗费用相差超过十倍。因此,更多长效产品的推出和普及,也是市场规模增长的潜力因素之一。
2.2上市产品类型多样,长效产品竞争变中有进
国内获批上市的生长激素以国产品牌为主,产品类型以短效为主。截至2023年,国内获批上市的生长激素相关产品共有10款,剂型分为水针(4款)、与粉针(6款)两种。从生产国来看,仅有健豪宁、尤得盼和诺泽为进口产品,从药效时长来看,以短效产品为主,长效产品数量稀少。
国内外长效生长激素产品稀少,国产金赛增于2014年作为全球首个长效生长激素获批上市。截至2023年,全球获批了四款长效生长激素,分别是金赛药业的 金 赛 增 、 诺 和 诺 德 的Sogroya、Ascendis的 隆 培 (Skytrofa) 和 辉 瑞 的Ngenla,其中金赛增是全球第一个长效生长激素产品,于2014年通过NMPA批准上市。
(1)Sogroya是诺和诺德将天然的人生长激素,经过修饰与血浆蛋白白蛋白结合延长其半衰期,使其可以每周给药一次的长效生长激素。它也是首款获FDA批准的用于治疗成人生长激素缺乏症的长效制剂,并于2023年4月获FDA扩大了适应症,用于治疗2.5岁及以上儿童的生长激素缺乏症。
特宝生物打破金赛药业长效产品垄断地位在望,预计未来竞争将促进长效产品市场纵深发展。怡培生长激素注射液(商品名:益佩生)是特宝生物自主研发的长效人生长激素,将用于治疗内源性生长激素分泌不足所致的儿童生长障碍。特宝生物2024年1月11日公告显示,怡培生长激素注射液药品注册上市申请已获得受理,未来该长效产品若成功获批上市,将拓展公司产品种类,增强公司整体竞争力。此前,金赛药业在国内长效产品上占据的垄断地位已保持十年,如今迎来特宝生物这一实质意义上竞争候选对手,而金赛药业多年来累积了品牌、技术、剂型、临床等多方面优势,其中长效产品适应症目前已经过IV期临床研究并显示出良好的安全有效性。目前长效产品虽相较短效产品优势明显,但产品获批适应症不及短效产品,市场份额相对较低。预计未来长效产品生产企业之间的竞争将促进产品获批适应症扩展、提升产品市场份额。
(2)隆培Skytrofa是由Ascendis基于TransCon(瞬时连接)技术开发的长效生长激素,是首个获FDA批准的治疗儿童生长激素缺乏症(PGHD)的长效生长激素药物。
(3)Ngenla是由OPKO原研的一款长效羧基末端肽(CTP)修饰的人生长激素,辉瑞在2014年与OPKO就Ngenla达成合成协议由OPKO负责实施临床项目,辉瑞负责产品注册和商业化,于今年6月28日被FDA已批准上市,用于治疗3岁以上因为内源性生长激素分泌不足导致生长缓慢的儿童患者。

3金赛药业领跑国内市场,多家药企布局生长激素
3.1金赛药业深耕生长激素二十余载,龙头地位稳固
研发实力过硬,推出全球首个长效重组人生长激素。金赛药业成立于1997年,是长春高新技术产业(集团)股份有限公司子公司,集自主研发、生产、营销和服务于一体,拥有PEG化长效生长激素的基因工程制药技术。在生长激素产品技术研发方面,金赛药业是中国乃至世界的领头羊,其创始人金磊独创“金磊大肠杆菌分泌型技术”并获得克莱文奖。金赛药业在1998年推出了第一支国产重组人生长激素粉剂,打破了进口产品的垄断局面,2005年推出亚洲首个重组人生长激素水针剂型,2014年公司成功研发出全球首个长效重组人生长激素。
院内水针金赛药业市场份额高达99%,长效水针逐步放量。据米内网统计,2022 年中国公立医疗机构终端重组生长激素67亿元销售规模,其中粉针剂市场,金赛药业超50%市占率,安科生物和联合赛尔紧随其后;水针剂市场,长春金赛市场份额高达99%,安科生物及诺和诺德合计占比不足1%。
新患入组工作逐步恢复,销售情况向好。2022年各企业新患入组工作普遍受阻。长春高新在2022年报中披露,在一线工作人员不断努力下,儿科产品(包括生长激素)的新患入组率仍保持了一定幅度的增长,总体保持了不到10%的增长。2023年1月,开始患者就诊积极性逐步恢复,2、3月份维持较高增幅,一季度入组人数同比增长约15%,在4、5月份新患入组同比增长40%的带动下,上半年新患整体增速超20%。
3.2长效产品利润丰厚,研发管线将迎百花齐放
金赛药业积极拓展金赛增适应症,新一代长效金赛增预计于2027年推出。截至2023年H1,金赛药业共有6款生长激素类在研产品,主要目的为提高长效型产品针对不同适应症的疗效,丰富完善战略领域产品线布局。长效产品金赛增已在美国申报临床III期。
长效产品毛利丰厚,在研管线丰富。面对丰厚的盈利空间,行业内他企业目前也在积极推进长效产品的研发与上市,其中特宝生物长效药品已完成临床III期研究且上市申请已获受理,安科生物已进入报产前准备阶段,维昇药业、天境生物等均已进入临床III期。
1)特宝生物Y型PEG化重组人生长激素:特宝生物的“Y型聚乙二醇重组人生长激素”项目采用的是获键凯科技在全球范围内独占专利许可的Y型分支型PEG。该项目于2023年三季度完成III 期临床研究,紧接着开展临床研究报告整理相关工作。2024年1月11日,该项目的长效人生长激素注射液的境内生产药品注册上市许可申请获得受理。
2)安科生物PEG化重组人生长激素注射液、AK2017注射液:PEG化重组人生长激素注射液已于2019年完成临床试验,目前已进入报产前准备阶段。同时安科生物还在开发重组人生长激素-Fc融合蛋白注射液长效制剂AK2017,相关临床试验申请于去年10月获得NMPA受理,现处于临床I期。
3)维昇药业Skytrofa:不同于金赛增用修饰的生长激素进行PEG化,Skytrofa是通过可水解接头将未修饰的22 kDa重组人生长激素分子共价连接到PEG载体制成,于2021年8月获FDA批准用于治疗儿童生长激素缺乏。丹麦生物制药公司Ascendis与维梧资本合资建立的维昇药业拥有Skytrofa在大中华区的独家授权,目前正在开展该产品的中国临床III期试验。
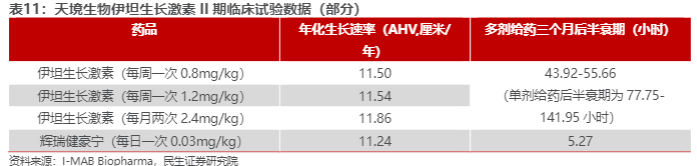
获FDA批准是基于3期heiGHt试验的结果:在第52周,Skytrofa治疗组的AHV( 年 化 生 长 速 率 ) 为11.2cm/年,每日注射短效生长激素AHV为10.3cm/年,治疗差异为0.9cm/年,在该试验中,Skytrofa达到了AHV非劣效性的主要目标。2022年11月,维昇药业公布了Skytrofa在中国III期临床试验的关键数据结果:Skytrofa或生长激素日制剂治疗52周后,AHV分别为10.66cm/年和9.75 cm/年,差异0.91cm。
本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。