2024创新药行业报告:IL-2融合蛋白治疗新突破
本周创新药重点关注
IL-2及IL-2R调控免疫细胞杀伤肿瘤
IL-2是调控免疫细胞杀伤作用的重要细胞因子,主要由抗原活化的CD4+T细胞分泌产生,其受体(IL-2R)主要表达在活化的T细胞、NK细胞、B细胞及单核巨噬细胞上。IL-2R是由α、β、γ三条链组成的异聚体,即IL-2Rα(CD25)、IL-2Rβ(CD122)、IL-2Rγ(CD132)。IL-2R具有亲和力不同的三种形式:三聚体IL-2R由IL-2Rα、β和γ组成,与IL-2的亲和力最强,二聚体IL-2Rβγ与IL-2亲和力中等,而当IL-2Rα亚基单独存在时,其与IL-2的亲和力只有三聚体IL-2Rαβγ的千分之一,且不会传导下游信号。因此,β/γ链为激活下游信号通路的必需组成,而α链则主要促进二者结合。
IL-2可以促进T细胞和NK细胞的激活和增殖,诱导淋巴因子激活的杀伤细胞(LAK)的产生,并诱导CTL、LAK等多种杀伤细胞的分化和效应功能,因此成为了肿瘤治疗的潜在靶点。
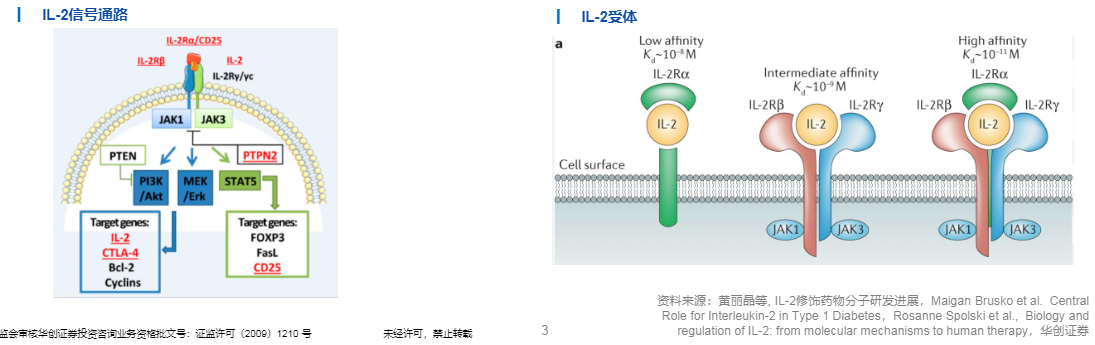
工程化改造IL-2以增强活性并降低毒副作用
然而,IL-2作为药物分子时有几个明显的缺点:1.半衰期短,只有13–85min,治疗时需要每天或隔天给药,患者依从性差。2.IL-2分子对免疫系统兼具刺激性和调节性:它既可以激活效应T细胞从而增强免疫,杀伤肿瘤细胞,但当其剂量过大而过度刺激免疫细胞时,又会导致表达IL-2R三聚体的Treg细胞增殖,抑制免疫反应,最终削弱药效。3.γ链可以被多种白介素识别,包括IL-4、IL-7、IL-9、IL-21等,此外,组成IL-2R中的的β链和γ链同时也是IL-15异三聚体受体的组成之一。因此,过度广泛的作用导致第一代野生型的高剂量IL-2疗法出现了严重系统性毒性。
为了规避上述几个短板,目前针对IL-2的开发热点在于对其进行工程化改造,在最大化IL-2治疗效果的同时,规避不良反应。一种常见的策略就是开发偏向性IL-2,通过突变改变IL-2和不同受体亚基的亲和力,以增强效应细胞和NK细胞的活化和增殖,同时避免IL-2R三聚体导致不必要的Treg细胞活化。
Nektar和赛诺菲:两款非ɑ偏向性IL-2先后失败
NektarTherapeutics开发的NKTR-214为最早的非ɑ偏向性IL-2候选药物之一,是IL-2Rβ(CD122)的激动剂。2018年2月,Nektar与BMS宣布就NKTR-214签署了一项全球战略开发和商业化合作协议。根据合作协议,两家公司将联合开发NKTR-214,并将其与BMS公司的Opdivo(纳武利尤单抗)、Opdivo+Yervoy(ipilimumab)联用,用于9种肿瘤类型的20多个适应症上,并将其商业化。根据协议,BMS将向Nektar预付18.5亿美元,其中包括10亿美元现金和以每股102.60美元的价格购买约828万股Nektar股票。
然而,2022年3月,公司公告称NKTR-214+Opdivo一线治疗黑色素瘤(PIVOT IO-001)的初步分析未达到主要终点。紧接着在2022年4月,NKTR-214+Opdivo一线治疗肾细胞癌的III期临床(PIVOT-09)和治疗顺铂不耐受膀胱癌的II期临床(PIVOT-10)在提前分析时均未显著改善疗效,因此,Nektar与BMS宣布终止NKTR-214+Opdivo联合治疗的所有临床研究。
除了NKTR-214 ,赛诺菲也于2022年10月28日,在第三季度报告中宣布将放弃其非α偏向性IL-2候选药物SAR444245,理由是在早期阶段收集的数据缺乏疗效。赛诺菲报告称,由于早期发现数据“低于预期”,目前用于II期试验的3周剂量计划将停止。
2019年,赛诺菲以25亿美元收购Synthorx时获得了SAR444245(THOR-707)的权益。SAR444245是采用聚乙二醇化的一种工程形式的IL-2候选药物,通过插入特定位点的新氨基酸可防止药物与ɑ亚基结合,同时仍允许药物与IL-2R的β/γ链结合。
信达生物IBI363采取独有的IL-2α偏向性设计
PD-1/IL-2双靶向药物能够同时阻断PD-1/PD-L1通路和激活IL-2通路,有望激活肿瘤杀伤性免疫细胞。绝大多数开发者仍然采取去除IL-2与IL-2Rα结合的策略,意图通过减少IL-2突变对Treg细胞刺激,从而降低免疫抑制并最大化IL-2的抗肿瘤效果。
然而,接连两个非α偏向性IL-2候选药物的失败表明使用非ɑ偏向性这种策略本身可能存在问题。业界认为,先前的研究可能过分强调了ɑ链激活对Treg细胞和内皮细胞的负面影响,而低估了ɑ链在肿瘤特异性T细胞(TSTs)上短暂上调时对IL-2信号传导和抗肿瘤免疫调节的重要性。
α-biased设计与“not-α”IL-2突变体相比较,可以更有效的激活肿瘤特异性CD8+ T细胞,展现出更优秀的抗肿瘤活性;在外周更偏向于扩增外周Treg细胞,从而减少IL-2带来的毒性;和抗PD-1具有协同作用,在PD-1耐药和转移模型中也表现出了突出的抑瘤效力。
目前在研的PD-1/IL-2融合蛋白中,仅有信达生物的IBI363在设计中,对IL-2臂采取α偏向策略。目前,IBI363用于治疗黑色素瘤、NSCLC等适应症正处于II期研究中。
IBI363是信达生物自主研发的first-in-classPD-1/IL-2α-bias双特异性抗体融合蛋白。IBI363的IL-2臂经过了设计改造,保留了其对IL-2Rα的亲和力,但削弱了对IL-2Rβ和IL-2Rγ的结合能力,以此降低毒性。IBI363的PD-1结合臂可以同时实现对PD-1的阻断和IL-2的选择性递送。
由于新激活的肿瘤特异性CD8+ T细胞(TSTs)同时表达PD-1和IL-2α,通过PD-1的特异性牵引,IBI363可以选择性刺激和扩增TSTs,从而发挥抗肿瘤作用,提升IL-2的治疗窗口。根据临床前数据,与“not-α”IL-2突变体相比较,保留IL-2Rα结合活性的α-biasedIL-2突变体可以更有效的激活TSTs。CD25与IL-2的接触在观察到的IL-2细胞因子与PD-1阻断之间的协同作用中具有重要作用。此外,在外周,“not-α”IL-2能够显著的扩增外周T细胞,而α-bias IL-2突变体更偏向于扩增外周Treg细胞,从而减少IL-2带来的毒性。
在2024年ESMO大会上,信达生物口头报告了IBI363治疗多种晚期实体瘤的最新Ia/Ib期临床数据(NCT05460767)。截至2024年4月16日,共347例晚期实体瘤受试者接受了IBI363单药治疗,剂量范围从0.2 μg/kg QW至3mg/kg Q3W。入组患者包括100例NSCLC、89例黑色素瘤、102例结直肠癌及56例其他肿瘤患者。其中,81.8%的受试者既往接受过2线及以上系统性治疗。在除结直肠癌以外的245例受试者中,84.1%的受试者入组前接受过免疫治疗。
有效性方面,在≥0.1mg/kg剂量范围内,共300名患者接受了至少一次基线后肿瘤评估,其中有3例CR和49例PR。在截止日期前,38名患者仍未发生疾病进展(PD),DoR尚未成熟。在既往接受过免疫治疗的204名患者中,ORR达到17.6%。在3mg/kg剂量组,共15名患者接受了至少一次基线后肿瘤评估,其中ORR达到46.7%, DCR 80.0%。
安全性方面,最常见的治疗相关不良事件(TRAE)是关节痛、贫血和甲状腺功能异常。≥3级TRAE的总体发生率为23.9%,≥3级免疫相关不良事件(irAE)的总体发生率为10.4%。3mg/kg Q3W剂量组的38例受试者中,13.2%的患者发生了≥3级TRAE,安全谱与总体人群类似,未发现新的安全性风险。
此次ESMO还公布了各细分癌种的有效性数据:•在驱动基因野生型NSCLC中,70名患者接受了≥0.3mg/kg IBI363治疗并至少接受了一次基线后肿瘤评估,其中77%既往接受过2线或以上系统性治疗,仅1例患者未接受过免疫治疗。总体ORR为27.1%,DCR为72.9%。在37例接受≥0.3mg/kg IBI363的肺鳞癌患者中(其中36例既往接受过PD-(L)1治疗,1例既往接受过TCE治疗),13名患者获得PR,ORR达到35.1%,DCR为75.7%。截止日期时,肺鳞癌的中位随访时间为5.7个月,中位PFS为5.5个月,13名PR患者中有11名仍处于缓解状态。•37例既往接受过免疫治疗的黑色素瘤患者中,接受了1mg/kg IBI363治疗并至少接受了一次基线后肿瘤评估,11名患者获得了客观缓解,包括1例CR和10例PR,ORR和DCR分别为29.7%和73.0%。•8例既往未经过免疫治疗的黏膜型黑色素瘤患者中,6名受试者达到客观缓解,其中1名患者的最佳疗效为CR,5名患者的最佳疗效为PR,总体ORR达到75.0%,DCR为100%。
此外,在2024ASCO大会上,信达生物还公布了IBI363治疗肠癌队列的研究结果(NCT05460767):试验纳入标准治疗失败的68名局部晚期或转移性结直肠癌患者,其中83.8%的患者为MSS/pMMR,其余患者MMR状态未知;76.5%的患者既往接受过≥3线系统治疗;61.8%的患者存在肝转移。患者将接受每周一次、每2周一次以及每3周一次100μg/kg至3mg/kgIBI363的治疗。
至少有一次基线后肿瘤评估的患者被纳入疗效可评估组。截至2023年12月22日,在5.3个月中位随访期内,所有剂量组患者的总体ORR为12.7% (8/63,其中1例CR,7例PR)。38名肝转移患者的ORR为13.2%。在13名PD-L1 CPS≥1的患者中,ORR为30.8%,DCR为76.9%。未达到中位生存期。
65例(95.6%)患者报告了治疗突发不良事件(TEAEs),其中22例(32.4%)患者的TEAEs等级≥3级。常见的TEAEs有关节痛(35.3%)、贫血(32.4%)、发热(22.1%)和低白蛋白血症(20.6%)。62名患者(91.2%)报告了与治疗相关的不良事件(TRAEs),其中16名患者(23.5%)≥3级。22例(32.4%)受试者报告了免疫相关不良事件(irAEs),其中4例(5.9%)≥3级。12例(17.6%)受试者出现严重不良反应。分别有25例(36.8%)和2例(2.9%)患者出现导致治疗中断和中止的TRAE。没有导致死亡的TRAE报告。2024年,信达生物计划启动IBI363在美国的II期临床。
罗氏的PD1-iL2v药物RG6279经改造可消除与IL-2Rɑ的结合,只激活IL-2Rβγ,从而避免与内皮细胞结合并优先扩增Tregs。在临床前Panc02小鼠肿瘤模型中,PD1-IL2v作为单药在消除肿瘤方面优于aPD-1单药或与FAP-IL2v联合用药。此外,PD1-IL2v可激活具有效应功能的、且并未出现的衰竭的独特CD8 TIL亚群,从而延长小鼠生存期。目前,RG6279治疗实体瘤的Ib期临床正在进行,其PartIII已在2023Q1完成首例患者入组。2022年9月,罗氏还以首付款2.5亿美金收购Good therapeutics的另一项PD-2/IL-2项目,并获得通过公司平台技术开发经PD-1调控的IL-2受体激动剂疗法的专属权利。
国内创新药回顾
本周创新药企公告
【歌礼制药】甘莱宣布在欧洲肝脏研究学会2024年大会以墙报形式展示了正在开展的每日一次ASC41治疗经活检证实的代谢功能障碍相关脂肪性肝炎患者52周的II期临床试验的12周积极期中结果。【君实生物】1、特瑞普利单抗(商品名:拓益®,产品代号:JS001)联合贝伐珠单抗一线治疗晚期肝细胞癌的III期临床研究HEPATORCH(NCT04723004)的主要研究终点无进展生存期(PFS)和总生存期(OS)均已达到方案预设的优效边界。HEPATORCH研究是一项多中心、随机、开放、阳性药对照的III期临床研究,旨在评估与标准治疗索拉非尼相比,特瑞普利单抗联合贝伐珠单抗一线治疗不可切除或转移性肝细胞癌的有效性和安全性;2、公司收到NMPA核准签发的《药品注册证书》,特瑞普利单抗(商品名:拓益®,产品代号:JS001)联合依托泊苷和铂类用于广泛期小细胞肺癌(ES-SCLC)的一线治疗的新适应症上市申请获得批准。
【泽璟制药】公司自主研发的1类新药盐酸吉卡昔替尼片(曾用名:盐酸杰克替尼片,新型JAK和ACVR1双抑制剂)治疗重症斑秃的III期临床主试验《盐酸杰克替尼片治疗重症斑秃患者的有效性和安全性的多中心、随机、双盲、安慰剂平行对照III期临床试验》(方案编号:ZGJAK018)达到了主要疗效终点,达到统计显著性(p<0.0001)。
【基石药业】1、公司宣布泰吉华®(阿伐替尼片,300mg)转移至境内生产的药品上市注册申请已获NMPA批准。预计将于2024年底或2025年初起逐步替代现有进口产品,从而实现国产化供应。泰吉华®是一种已上市的精准疗法,用于治疗携带PDGFRA外显子18突变(包括PDGFRAD842V突变)的不可切除性或转移性GIST成人患者;2、公司宣布泰吉华®(阿伐替尼片,300mg)转移至境内生产的药品上市注册申请已获NMPA批准。预计将于2024年底或2025年初起逐步替代现有进口产品,从而实现国产化供应。泰吉华®是一种已上市的精准疗法,用于治疗携带PDGFRA外显子18突变(包括PDGFRAD842V突变)的不可切除性或转移性GIST成人患者。
【荣昌生物】注射用维迪西妥单抗(商品名:爱地希®)治疗HER2阳性存在肝转移的晚期乳腺癌患者的随机、开放、平行对照、多中心III期临床研究取得阳性结果,达到临床试验主要研究终点。该项目已于2021年6月获得NMPA授予的突破性疗法认定。公司计划近期向NMPACDE递交上市申请。
【荃信生物】QX005N注射液治疗结节性痒疹(PN)的II期临床试验(CTR20223174)数据在中华医学会第二十九次皮肤性病学术年会上以口头报告形式发布。该试验为国内首个由中国企业开展的针对PN适应症的生物药临床试验,基于该项试验数据,QX005N于今年1月31日被国家药品监督管理局药品审评中心纳入突破性治疗品种名单。QX005N是一款以人IL-4受体α亚基(IL-4Rα)为靶点的创新型人源化单克隆抗体。
全球创新药速递
礼来:tirzepatide显著改善MASH患者疾病相关指标
6月8日,礼来公布了其GIP/GLP-1双重受体激动剂tirzepatide用于治疗代谢功能障碍相关脂肪性肝炎(MASH)患者的II期临床试验SYNERGY-NASH的结果。SYNERGY-NASH是一项II期研究,纳入190名患或不患有2型糖尿病、经活检证实患有代谢功能障碍相关性脂肪性肝炎(MASH)的成人患者,所有患者都伴有2期或3期肝纤维化。
疗效评估结果显示,在一周1次接受皮下注射5mg、10mg和15mgtirzepatide的患者中,分别有51.8%、62.8%和73.3%的患者在治疗52周后不再出现MASH且肝组织学检查显示肝纤维化没有恶化,而服用安慰剂的患者中只有13.2%的患者达到了这一研究主要终点。
次要终点方面,三个tirzepatide治疗组中分别有59.1%、53.3%和54.2%的患者的纤维化得到了1期或更大程度的改善且MASH没有恶化,而服用安慰剂的患者中,这一比例只有32.8%。对其他次要终点的评估显示,tirzepatide与体重、肝损伤血液标志物以及肝脏脂肪、炎症和纤维化生物标志物的改善有关。
安全性方面,tirzepatide在SYNERGY-NASH试验中的总体安全性与之前在SURMOUNT和SURPASS试验中观察到的安全性相似。在SYNERGY-NASH试验中,最常报告的不良事件与胃肠道有关(恶心、腹泻、食欲下降、便秘和体重减轻),严重程度一般为轻度至中度。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)