2024年创新药行业周报:血液瘤ADC药物研发进展分析
本周创新药重点关注
血液瘤ADC药物研发热度显著低于实体瘤
ADC是目前肿瘤领域最受关注的研发方向。截止2024年5月,全球一共15款ADC药物获FDA批准上市,其中8款用于治疗实体瘤。2023年,上市ADC药物销售额超百亿美元,其中HER2 ADC Enhertu以23.15亿美元的全球销售额位居第一。目前ADC在研管线中靶向实体瘤的药物显著较血液瘤靶点更多,III期占比分别为100%vs 0%,II期占比为84%vs 14%。血液瘤ADC药物研发难度大。全球首款获批上市的ADC药物为辉瑞的CD33ADCMylotarg,2000年加速获批用于治疗血液瘤,由于疗效及安全性不佳,于2010年退市,2017年重新以低剂量上市。Mylotarg除了未显示出明显的临床益处,还出现了严重的安全性问题,治疗组死亡率高于化疗组。GSK的BCMAADCBlenrep于2020年获批,之后由于在确证性临床中未达到研究终点而被撤市。此外,血液瘤领域CAR-T、双抗等多种新机制疗法已获得验证,目前有12款治疗血液瘤的CAR-T疗法和7款双抗药物获批上市。这些药物疗效优异,安全性好,使得血液瘤ADC面临更强的竞争。
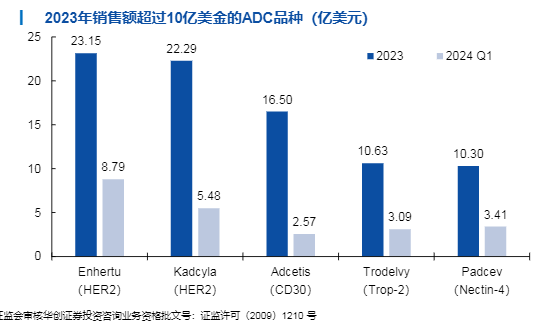
两款已上市血液瘤ADC商业化表现突出
证券研究报告证监会审核华创证券投资咨询业务资格批文号:证监许可(2009)1210 号两款已上市血液瘤ADC商业化表现突出4尽管如此,仍有两款安全性及疗效优异的血液瘤ADC填补了未满足的临床需求,商业化表现突出。罗氏研发的CD79b ADC Polivy®于2019年获批,用于治疗R/R DLBCL。非霍奇金淋巴瘤(NHL)是最常见的血液系统恶性肿瘤之一,弥漫大B细胞淋巴瘤(DLBCL)是NHL最常见的亚型,占全球新诊断病例的30-40%。DLBCL的一线标准治疗方案可治愈约60%的患者,但40%左右的患者仍会复发或难治,R/R DLBCL患者的预后不佳。2023年,基于III期试验POLARIX的结果,FDA批准Polivy®联合R-CHP方案用于一线治疗DLBCL,成为近20年来FDA批准的首个一线DLBCL疗法。Polivy®的销售额已从第一个完整销售年2020年的1.69亿瑞士法郎(约1.86亿美元)突破至2023年的8.37亿瑞士法郎(约9.20亿美元)。2011年,武田/辉瑞的Adcetris®首次获得FDA批准上市,至今已获批包括一线经典霍奇金淋巴瘤(cHL)、二线cHL、一线外周T细胞淋巴瘤(PTCL)在内的7个适应症。Adcetris®自上市以来销售额稳步提高,2023年达到16.5亿美元,成为当年销售额第三的ADC。
Zynlonta(loncastuximabtesirine)是一款由ADCTherapeutics公司开发的CD19 ADC,使用PBD二聚体作为毒素。FDA和EMA分别于2021年4月以及2022年12月批准其用于治疗经过两线及更多线系统治疗后复发或难治(r/r)的大B细胞淋巴瘤成人患者,包括弥漫大B细胞淋巴瘤(DLBCL)、低级别淋巴瘤引起的DLBCL以及高级别B细胞淋巴瘤。2021年至2023年,Zynlonta分别取得3392、7491以及6906万美元的销售额。ADCtherapeutics正积极对Zynlonta进行适应症拓展,开展了旨在将其从DLBCL3L治疗向2L推进的LOTIS-5(Zynlonta+利妥昔单抗)及LOTIS-7(Zynlonta+BsAbs)试验,以及探索2L治疗滤泡性淋巴瘤(FL)和2L治疗边缘区淋巴瘤(MZL)的IIT试验。
5月6日,ADC Therapeutics宣布其CD19ADCZynlonta® (loncastuximabtesirine)在一项单臂、开放标签的II期临床试验(NCT05296070)中初步取得积极数据。结果显示,高达86.7%接受Zynlonta治疗的复发/难治性(r/r)边缘区淋巴瘤(MZL)患者达到完全缓解(CR)。MZL是第三常见的B细胞非霍奇金淋巴瘤(B-NHL),起源于淋巴滤泡的边缘区,约占NHL的7-10%。MZL的原发部位较多、分型复杂、异质性高,因此缺乏规范有效的治疗方案;此外,MZL前瞻性研究较少,治疗手段有限。本次公布的这项II期临床共纳入50名曾接受过≥1种系统疗法的r/r MZL患者,旨在评估使用为期18周的6个周期的Zynlonta的安全性和有效性。截至2024年3月30日,共有15名患者接受了评估,其中13人获得了完全应答(CR),1人获得了部分应答(PR),所有获得应答的患者在数据截止时都保持了应答。安全性方面。Zynlonta耐受性普遍良好,共有两名患者因毒性反应停药,停药后毒性完全消失,这两名患者分别在10个月和6个月后仍处于CR状态。
Blenrep:末线治疗R/R MM因确证性临床未达终点撤市
GSK的First-in-ClassBCMAADCBlenrep®(belantamabmafodotin)最初于2020年获得FDA的加速批准,用于末线治疗复发性或难治性多发性骨髓瘤(RRMM)成人患者。2022年11月7日,GSK宣布在RRMM患者中进行的Blenrep单药对照泊马度胺联合低剂量地塞米松(PomDex)的III期开放标签、随机、头对头优效试验DREAMM-3未达到主要终点PFS。在该试验中,Blenrep治疗组(n=214)和对照组(n=106)的PFS分别为11.2和7.0个月,HR为1.02(p=0.558);次要终点ORR分别为41%和36%。在进行主要分析时,OS数据的总体成熟度仅为37.5%。Blenrep组和PomDex组的中位OS分别为21.2个月和21.1个月,HR为1.14。在III期临床试验失败不久后,GSK宣布将根据美国FDA的要求撤回Blenrep的上市许可,2022年12月,Blenrep撤出美国市场。然而,此次撤市并没有使BMS彻底放弃Blenrep,在DREAMM-3失败后,还有8条Blenrep治疗RRMM的DREAMM系列管线仍在继续推进,覆盖1L以及2L+治疗。
Blenrep:二线治疗R/R MM取得积极结果
2024年2月5日及2024年3月7日,GSK分别宣布取得积极的DREAMM-7中期分析结果以及DREAMM-8顶线结果。DREAMM-7头对头研究了Blenrep联合硼替佐米加地塞米松(BorDex)与daratumumab+BorDex在治疗2L RRMM时的效果。中期分析结果显示,与daratumumab联合疗法(n=251)相比,Blenrep联合疗法(n=243)的PFS获得了具有临床及统计学意义的改善,疾病进展或死亡风险降低了59%。在28.2个月的中位随访时间中,Blenrep联合疗法的中位PFS为36.6个月,而daratumumab组合为13.4个月。试验在所有预设亚组中都观察到了PFS效应,包括来那度胺难治患者和高风险细胞遗传学患者。安全性方面,Blenrep联合疗法的安全性和耐受性情况与已知的单药情况一致,两个治疗组中值得临床关注的3级及以上非眼部不良事件分别包括血小板减少症(55%和35%)、中性粒细胞减少症(12%和6%)、肺炎(12%和4%)、中性粒细胞减少症(12%和6%)、肺炎(12%和4%)以及贫血(8%和10%)。34%的Blenrep组患者出现了3级及以上眼部不良反应,可通过调整剂量加以控制且通常是可逆的,导致治疗中断的比例为9%。DREAMM-8头对头研究了Blenrep联合泊马度胺加地塞米松(PomDex)与硼替佐米+PomDex在治疗2L RRMM时的效果的治疗。顶线结果显示,与硼替佐米联合疗法相比,Blenrep联合疗法明显延长了患者的疾病进展或死亡时间,并观察到了有利于Blenrep组合的积极OS趋势,该试验将继续跟踪观察OS结果。安全性方面,Blenrep方案的安全性和耐受性与已知的单药安全性特征基本一致。
早在2000年,FDA就加速批准了辉瑞旗下的CD33 ADC Mylotarg®(Gemtuzumabozogamicin,GO)上市,用于治疗60岁以上首次复发的CD33阳性急性髓系白血病(AML)患者。但在随后的确证性试验SWOG 106(NCT00085709)中,Mylotarg用药组不但未显示出明显的临床益处,且死亡率高于标准治疗组,因此辉瑞于2010年主动申请Mylotarg退市。SWOG 106是一项随机III期临床,评估了在AML患者的标准诱导及巩固治疗中添加GO的潜在益处。患者被随机分配接受标准诱导疗法,即多柔比星+阿糖胞苷(DA)疗法,或多柔比星+阿糖胞苷+GO(DA+GO)疗法。获得CR的患者将接受3个疗程的大剂量阿糖胞苷巩固治疗,巩固治疗后仍为CR的患者将随机不接受额外治疗或接受3次GO治疗。共有637名患者接受了诱导治疗,DA+GO组的CR率为69%,DA则为70%。在获得CR的患者中,DA+GO组的5年无复发生存率(RFS)为43%,DA组为42%。DA+GO组和DA组的5年OS分别为46%和50%。174名在诱导实验中达到CR的患者接受了随机分组,在巩固治疗后接受3次GO并未提高患者无病生存率(HR,1.48)。在这项研究中,在诱导治疗或巩固治疗后添加GO未能改善CR率、DFS或OS。安全性方面,Mylotarg治疗组的死亡率远高于标准治疗组(5.7% vs 1.4%),因此临床研究被迫提前终止。
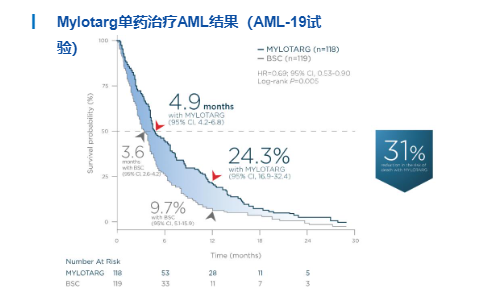
Mylotarg:低剂量治疗AML重新上市
Mylotarg®退市后,辉瑞重新设计了一系列的临床试验,证明了Mylotarg具有优异的收益风险比。最终依照专家咨询委员会6:1的投票结果,Mylotarg于2017年重新获得FDA批准上市,成为治疗AML的一线药物之一。在一项针对271名新确诊的CD33阳性AML患者的试验ALFA-0701中,患者被随机分配接受DA或DA+GO治疗。与单独接受化疗的患者相比,接受Mylotarg联合化疗的患者无并发症生存期更长(中位无事件生存期为17.3个月vs 9.5个月)。Mylotarg作为独立疗法的安全性和有效性则是基于AML-19以及MyloFrance-1试验的数据。AML-1试验纳入237名新确诊的AML患者,接受Mylotarg单药或最佳支持治疗(BSC),两组的中位总生存期分别为4.9个月及3.6个月。MyloFrance-1是一项单臂实验,纳入了57名CD33阳性、复发过一次的AML患者接受一个疗程的Mylotarg治疗,最终26%的患者获得了中位持续11.6个月的CR。虽然重新上市,但FDA仍然没有摘除Mylotarg可能会导致“肝毒性,包括严重或致命的肝静脉闭塞症(VOD)”的黑框警告。目前,Mylotarg除了已上市的AML适应症外,还在尝试骨髓增生异常综合征、急性早幼粒细胞白血病等适应症。
除Mylotarg外,还有4款处于临床I期的靶向CD33的候选ADC药物,均只针对AML适应症。百利天恒的BL-M11D1由gemtuzumab(CD33特异性抗体)、可被cathepsin B裂解的连接子和新型拓扑异构酶I抑制剂Ed-04组成,DAR值为8。BL-M11D1目前正处于Ia期临床研究阶段,针对AML已展现出强烈的有效性信号。
MRG001是由乐普生物研发的CD20ADC,通过vc连接子偶联了重组嵌合抗CD20单克隆抗体与毒素MMAE。MRG001已完成首次人体试验的剂量递增研究,确定1.8mg/kg、每3周给药1次是其推荐II期给药剂量。乐普在2023年第65届ASH大会上报道了MRG001在既往经至少二线治疗进展的R/R DLBCL患者中的疗效,全部患者均经过抗CD20的治疗。
截至2023年07月28日,共入组35名DLBCL患者,既往接受的中位治疗线数为3线(范围2-7线)。至数据截止日,研究中位随访时间为6.8月,可评估患者共34例,客观缓解率(ORR)为38.2%(95% CI:22.2,56.4)。其中,6例患者达到完全缓解,占比17.6%;7例患者肿瘤部分缓解,占比20.6%;10例患者疾病稳定,占比29.4%,疾病控制率(DCR)为67.7%(95% CI:49.5,82.6)。在未接受过CAR-T治疗的患者中,ORR为44.4%(12/27),DCR为70.4%。患者的中位缓解持续时间(DoR)为10.5个月(95%CI:10.5,NE),中位无进展生存期(PFS)为5.2个月(95%CI:2.4,12.0),中位总生存期(OS)尚未成熟,12个月的生存率为64.4%(95%CI:45.4,91.4)。
对于未接受过CAR-T治疗的患者,其中位PFS为6.3个月(95%CI:2.4,NE)。患者对MRG001治疗的耐受性良好,不良事件均可以管理。最常报道的治疗相关不良事件(TRAE)是白细胞降低(68.6%),中性粒细胞计数降低(65.7%),贫血(45.7%),AST升高(40.0%)以及淋巴细胞计数降低(31.4%)。最常见的3/4级TRAE有中性粒细胞计数降低(40.0%),白细胞降低(17.1%)及淋巴细胞计数降低(11.4%)。MRG001的神经毒性发生率为5.7%(2/35),均为1/2级反应。大部分患者的TRAE经过对症治疗后均可以恢复,仅2例患者因TRAE而终止治疗,未有患者因TRAE而导致死亡。
TRS005是由浙江特瑞思药业股份有限公司自主研发的CD20ADC,采用MMAE作为毒素。一项多中心、单臂、剂量递增的I期临床研究探索了TRS005单次及多次用药治疗r/r CD20阳性的B细胞非霍奇金淋巴瘤(NHL)患者的安全性、耐受性、药代动力学特征及初步有效性。2022年9月,TRS005在ESMO大会上公布最新的I期临床研究数据。数据显示,在既往接受过2线及以上的NHL患者中,TRS005展现出了良好的疗效及可控的安全性。这项I期研究共纳入48例CD20阳性的B细胞NHL患者,既往治疗的中位线数为4线。45例可评估患者的客观缓解率(ORR)为42.2%,其中完全缓解(CR)为11.1%。
弥漫性大B细胞淋巴瘤(DLBCL)、滤泡淋巴瘤(FL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)和慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的ORR分别为52.9%、26.3%、60.0%、66.7%和0%。0.5、1.0、1.5和1.8mg/kg剂量组的ORR分别为42.9%、33.3%、43.8%和50.0%;其中,1.8 mg/kg剂量组的ORR(CR为14.3%,PR为35.7%)和DCR(85.7%)均为最高。在试验中,TRS005在所有NHL亚型中都展现出了良好的疗效,68.9%的患者病灶缩小,75.6%的患者病情得到控制。截止目前,入组的全部病例中未发现治疗相关死亡事件。常见的3级及以上相关AE为血液学毒性相关事件,如:中性粒细胞减少、白细胞减少、淋巴细胞减少等;最常见的非血液毒性相关AE为AST升高、发热和ALT升高等;全部AE以1-2级为主,3级及以上相关AE均可通过干预有效控制。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)