2024医药生物行业报告:国产创新药出海加速兑现分析
1. 板块观点
1.1. 医药估值极具有吸引力,重点推荐中药OTC及创新药
本周、年初至今医药指数涨幅分别为-2.72%、-18.25%,相对沪指的超额收益分别为-1.42%、-20.13%;本周生物制品(-1.79%)、医疗器械(-1.91%)及化药(-2.15%)等股价跌幅较小,医疗服务(-4.41%)、中药(-3.96%)及医药商业(-3.67%)等股价跌幅较大;本周涨幅居前诺泰生物(+26.07%)、金凯生科(+23.83%)、南华生物(+17.26%),跌幅居前葵花药业(-13.04%)、广誉远(-12.86%)、健民集团(-10.55%)。涨跌表现特点:本周医药板块大小市值出现普跌,小市值个股跌幅较小,但诺泰生物业绩超预期拉动GLP1板块上涨。
随着今年对个股确定性要求较高,创新药板块也不例外。国产创新药国际化将是创新药选股的主要标的,年初以来创新药国际化确定性高的标的股价走势异常强势,例如科伦博泰、百利天恒、海思科等;近日国内创新药出海好消息不断,如亚盛医药的第三代BCR-ABL奥雷巴替尼以首付款及里程碑13亿美金授权给国际巨头武田制药;近日和黄医药的VEGFR靶点的呋喹替尼治疗转移性结直肠癌在欧洲获批。创新药出海,重点推荐:科伦博泰、百利天恒、和黄医药、海思科等。另外和黄医药呋喹替尼的OS、PFS都达到临床终点于欧盟获批,根据WHO数据,结直肠癌是全球第三大肿瘤,每年全球新增190万患者,随着年内日本也会获批,成为结直肠癌靶向治疗新选择。
2. 结直肠癌大市场,呋喹替尼成功出海欧美
2.1. 结直肠癌在全球都有高发病率和高死亡率
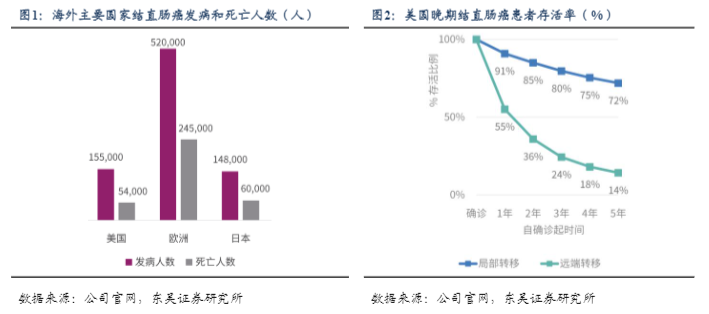
根据Global Cancer Observatory的数据,结直肠癌(CRC)是全球发病人数第三,我国发病人数第二的癌症,2020年全球发病人数约193万,而其中超过25%为中国人,CRC亦是全球死亡人数第二的癌症。2020年,美国约有15.5万个新发CRC患者,而中国和欧洲高达55.5万、52万人。转移性结直肠癌(mCRC)约占美国新确诊的CRC患者的23%,mCRC的预后并不理想,患者生存期短,五年总生存率约14%。而中国新发的CRC患者中约27.5%为转移期,五年生存率仅10%,存在极大未满足临床需求。
2.2. 后续结直肠癌疗法近10年无新的靶向药上市
结直肠癌的前线治疗以奥沙利铂、伊立替康为主的化疗、贝伐珠单抗(抗血管生成,VEGF靶点)和西妥昔单抗(EGFR靶点)为基础。因为结直肠癌是典型的“冷肿瘤”,仅针对dMMR/MSI-H 亚组患者使用PD-1单抗治疗。三线结直肠癌患者的疗法有限,除了上述提到的化疗、抗VEGF和抗EGFR疗法外,主要以瑞戈非尼(2012年上市)和TAS-102(2015年上市)为主。近10年来后线结直肠癌都没有新的靶向药上市,存在很大的未被满足的临床需求。
不管是2024年NCCN指南还是国内的2024年CSCO指南,均将呋喹替尼列为后线结直肠癌治疗的一级推荐。权威指南的推荐奠定了呋喹替尼在后线转移性结直肠癌患者中的治疗地位,有利于合作伙伴武田的海外商业化推广。
2.3. 呋喹替尼是后线结直肠癌治疗的“同类最佳”选择
和黄医药的呋喹替尼是一种高选择性及强效的血管内皮生长因子受体(VEGFR 1、2及3)的口服抑制剂,对VEGFR3的选择性是非VEGFR靶点的250倍,相比于其他的抗血管生成激酶抑制剂具有更好的靶点选择性,良好的安全性。呋喹替尼通过抑制血管内皮细胞表面的VEGFR磷酸化及下游信号转导,抑制血管内皮细胞的增殖、迁移和管腔形成,从而抑制肿瘤新生血管的形成,肿瘤便无法获得肿瘤血管提供的生长所必需的营养和氧气,达到“饿死肿瘤”的目的。
针对美国和欧洲的获批是基于两项大型、随机对照III期临床试验的数据,即国际多中心临床试验FRESCO-2研究以及于中国开展的FRESCO研究,在总共734名接受呋喹替尼治疗的患者中展现出了一致的获益和安全性特征。值得关注的是,北美洲、欧洲和亚洲人群的亚组分析总生存期均获益明显,既往经过抗VEGF治疗、抗EGFR治疗、瑞戈非尼和TAS-102治疗后的患者总生存期也均获益,体现了后线CRC治疗中呋喹替尼的显著优势和最佳的治疗选择。
呋喹替尼相比竞品,有效性优势明显。呋喹替尼在单药的mOS约为7.4个月,相对安慰剂的mOS提升约2.6个月,HR=0.66;竞品瑞戈非尼和TAS-102的mOS相比安慰剂分别提升1.4个月(HR=0.77)和1.8个月(HR=0.68)。
2.4. 呋喹替尼联用PD1进一步延长患者用药时长
呋喹替尼联用PD1,mPFS接近翻倍。2022年ASCO上公布了呋喹替尼联合特瑞普利单抗在微卫星稳定(MSS, 这类患者占95%左右,且对免疫检查点单药治疗不敏感)三线结直肠癌种的单臂单中心II期临床试验结果,该临床共入组30个患者,接受240mgQ3W特瑞普利单抗+5mg呋喹替尼,患者的ORR高达16.7%,DCR为54.1%,中位无进展生存期为6个月。2021年ASCO公布呋喹替尼联合信迪利单抗在三线结直肠癌种的疗效,5mg剂量组ORR为27.3%,DCR高达95.5%,PFS达6.8个月。这些数据显示了呋喹替尼联合PD1能够明显提升其在晚期结直肠癌患者中的疗效,显示二者联用的潜力。
2.5. 呋喹替尼国内市占率第一,海外放量加速
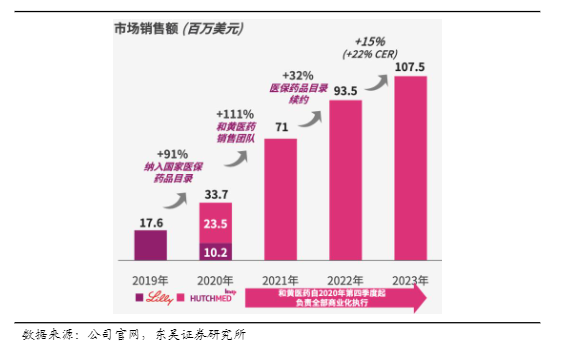
呋喹替尼国内销售额逐年攀升,2023年国内销售额约1亿美金。根据IQVIA数据库,三线结直肠癌市场中院内销售市占率达47%。呋喹替尼于2023年11月于美国获批上市,2024Q1美国销售额约5000w美金,美国的月治疗费用约为2.5万美金,定价约为国内定价的24倍,全年海外销售额至少1.4亿美金。日本今年9-10月份有望获批上市。
呋喹替尼未来还会拓展晚期胃癌,子宫内膜癌和肾细胞癌适应症:
呋喹替尼和紫杉醇联用治疗2L 胃癌的3期临床达到了1个主要终点(mPFS,5.6 vs 2.7,HR=0.57),OS全人群未达到终点,亚组分析达到(后续未经抗肿瘤治疗的亚组达到6.9 vs 4.8,HR=0.72),2023M4 CDE受理了上市申请,预计2024Q3国内获批上市。
呋喹联用信迪利单抗针对2L子宫内膜癌(pMMR)获得CDE的突破性疗法认证,2024年年初国内已递交NDA。
国内尚无PD1/VEGF抑制剂的联合疗法获批一线或二线肾细胞癌。呋喹替尼联合信迪利单抗针对2L 肾细胞癌的2期临床结果展示了非常好的疗效数据:mPFS达到约16个月,ORR=60%,安全性可控。预计今年年底完成入组,2025年国内申报上市。
3. 研发进展与企业动态
3.1. 创新药/改良药研发进展(获批上市/申报上市/获批临床)
6月21日,CDE网站显示,阿斯利康的奥希替尼新适应症上市申请正式获得受理,根据临床试验进展,推测本次申报上市新适应症为:用于在接受含铂根治性放化疗后未出现疾病进展、具有表皮生长因子受体(EGFR)外显子19缺失(Ex19del)或外显子21(L858R)置换突变的局部晚期不可切除(III期)非小细胞肺癌(NSCLC)成人患者的治疗。
6月20日,诺诚健华宣布国家药监局(NMPA)已受理CD19单抗坦昔妥单抗(tafasitamab)联合来那度胺治疗不适合自体干细胞移植条件的复发/难治弥漫性大B细胞淋巴瘤(DLBCL)成人患者的生物制品上市许可申请(BLA),并纳入优先审评。
6月20日,强生宣布古塞奇尤单抗(商品名:Tremfya)皮下注射(SC)剂型诱导治疗中重度活动性克罗恩病(CD)成年患者的III期GRAVITI研究取得了积极结果。基于该研究和两项头对头III期研究(GALAXI 2和GALAXI 3)的积极结果,强生已向FDA递交古塞奇尤单抗治疗CD的上市申请。
6月20日,阿斯利康AKT抑制剂capivasertib已在欧盟获批,与氟维司群联合用于治疗雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)、伴有一种或多种PIK3CA、AKT1或PTEN基因突变的局部晚期或转移性乳腺癌成年患者,这些患者在使用基于内分泌的治疗方案后复发或病情进展。
6月19日,Sobi宣布,其与赛诺菲共同开发的Altuvoct(efanesoctocog alfa)已经获得欧盟委员会(EC)批准上市,用于血友病A成人和儿童患者的常规预防性治疗和按需治疗,以控制出血事件,以及围手术期管理(手术)。
6月19日,迪哲医药宣布,公司自主研发的I类新药——淋巴瘤领域全球首个且唯一高选择性JAK1抑制剂高瑞哲®(通用名:戈利昔替尼胶囊)正式获得国家药品监督管理局(NMPA)批准,单药适用于既往至少接受过一线系统性治疗的复发或难治的外周T细胞淋巴瘤(r/r PTCL)成人患者。
6月18日,艾伯维宣布,FDA批准其IL-23抑制剂利生奇珠单抗(Skyrizi)用于治疗中度至重度活动性溃疡性结肠炎成人患者,使其成为首个批准用于治疗中度至重度溃疡性结肠炎和中度至重度克罗恩病的IL-23特异性抑制剂。利生奇珠单抗现已获批四项免疫介导炎症性疾病适应症。
6月17日,默沙东宣布FDA已批准其21价肺炎球菌结合疫苗Capvaxive(V116)的生物制品许可申请(BLA),这意味着V116成为首个专为成人设计的肺炎球菌结合疫苗,其获批适应症为:在18岁及以上的个体中,为预防由肺炎链球菌血清型3、6A、7F、8、9N、10A、11A、12F、15A、15B、15C、16F、17F、19A、20A、22F、23A、23B、24F、31、33F和35B引起的侵袭性疾病而进行主动免疫接种;在18岁及以上的个体中,为预防肺炎链球菌血清型3、6A、7F、8、9N、10A、11A、12F、15A、15C、16F、17F、19A、20A、22F、23A、23B、24F、31、33F和35B引起的肺炎而进行主动免疫接种。此适应症获加速批准,此适应症的持续批准可能取决于日后验证性试验的结果。
6月17日,默沙东宣布帕博利珠单抗(Keytruda,K药)的补充生物制品许可申请(sBLA)获FDA批准,用于联合标准化疗(卡铂和紫杉醇)治疗原发性晚期或复发性子宫内膜癌患者。这意味着,K药成为子宫内膜癌领域首个无视错配修复状态的一线免疫疗法。这也是K药在子宫内膜癌领域获批的第3项适应症,同时也是其在美国获批的第40项适应症。
6月17日,荣昌生物宣布泰它西普一项新适应症在中国获批临床,用于有复发风险的IgG4相关性疾病(IgG4-RD)患者。
6月17日,阿斯利康宣布Imfinzi(度伐利尤单抗)获FDA批准新适应症,用于与卡铂和紫杉醇联用后再进行Imfinzi单药治疗错配修复缺陷(dMMR)的成人原发性晚期或复发性子宫内膜癌患者。该药物是第一个获批子宫内膜癌适应症的PD-L1单抗。
6月17日,正大天晴抗肿瘤1类创新药枸橼酸依奉阿克胶囊(TQ-B3139)获得国家药监局(NMPA)批准上市,用于治疗未接受过间变性淋巴瘤激酶(ALK)抑制剂治疗的ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)