2024年医药行业创新药发展报告
一、诺诚健华:专注肿瘤自免的小分子创新药企
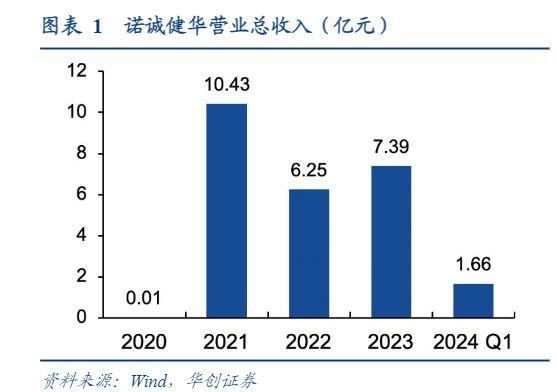
诺诚健华成立于2015年,是一家专注于开发治疗肿瘤及自身免疫性疾病药物的创新药企。公司首款创新药BTK抑制剂奥布替尼已在中国和新加坡获批上市,并纳入中国国家医保目录;引进自Incyte的CD19单抗坦昔妥单抗在香港获批上市,并在博鳌和大湾区获批使用。2023年,公司营收达7.4亿人民币,同120比上涨18.1%;净利润亏损同比收窄27.8%,减少至6.5亿人民币。2024年一季度营收1.66亿元,毛利水平持续提高,1-3月毛利率为85.4%,同比提高8.1%。公司现金充足,截至2024年3月31日,持有货币资金约82亿人民币。
二、血液瘤:适应症全面布局
诺诚健华在血液瘤领域布局6款产品,覆盖骨髓瘤、白血病及非霍奇金淋巴瘤各个细分适应症,其中奥布替尼治疗r/rCLL/SLL、r/rMCL和r/rMZL三个适应症已获得批准。2024年,诺诚健华会在中国内地就两个适应症申请NDA,分别是奥布替尼单药一线治疗CLL/SLL以及坦昔妥单抗联合来那度胺治疗r/r DLBCL;在海外,公司计划今年向FDA递交奥布替尼治疗r/r MCL的上市申请。
(一)奥布替尼:新适应症拓展,销售稳步放量布鲁顿氏酪氨酸激酶(Bruton's tyrosine kinase,BTK)是一种高度保守的非受体型酪氨酸激酶,属于TEC受体家族,其位于B淋巴细胞受体(BCR)下游,可通过介导多条信号通路活化从而调控B细胞的发育和成熟。B细胞在分化和活化的不同阶段发生恶性增殖会导致多种类型的B细胞淋巴瘤,如急性淋巴细胞白血病(ALL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)等。BTK活化可通过级联磷酸化信号传导促进B细胞的增殖、分化和迁移,在B细胞淋巴瘤中发挥关键致病作用。抑制BTK活性可阻断BCR下游信号通路活化,造成B细胞黏附和迁移受阻,最终导致B细胞淋巴瘤的缩小或消失。因此,BTK成为了治疗B细胞淋巴瘤的有效靶点。目前全球共有6款BTK抑制剂获批上市,2023年合计销售额达127亿美元。
国内已上市的BTK抑制剂为伊布替尼、泽布替尼、奥布替尼和阿可替尼,其中诺诚健华的奥布替尼是国内第三款获批的BTK抑制剂,也是唯一一款在国内获批治疗r/r MZL的BTK抑制剂。
作为第二代不可逆共价结合的BTKi,奥布替尼在第一代BTKi基础上进行了结构优化,使其与BTK活性中心更匹配,可以提高BTK的激酶抑制性和选择性。根据KINOMEscan平台的测定,1 μmol/L奥布替尼在456种激酶的选择性检测中,仅对BTK的抑制作用超过90%,而极少与其他激酶靶点结合。因此,奥布替尼脱靶毒性相较其他BTKi更低,具有更好的疗效和安全性。
1、奥布替尼治疗MZL:国内独家适应症,有望显著推动销售增长边缘区淋巴瘤(MZL)是一组B细胞淋巴瘤,起源于淋巴滤泡的边缘区,包括黏膜淋巴组织结外、结内和脾三种亚型。MZL是第二常见的B细胞非霍奇金淋巴瘤(B-NHL),约占NHL的7-10%。根据中国NHL发病率和MZL占比,估算MZL发病率为0.4/10万人,好发于老年人。MZL的原发部位较多、分型复杂,其诊断、治疗和预后具有高度异质性,因此缺乏规范有效的治疗方案,此外,MZL前瞻性研究较少,治疗手段有限。奥布替尼于2023年4月获批用于MZL适应症。目前,奥布替尼、伊布替尼以及泽布替尼均已被CSCO《淋巴瘤诊疗指南(2023)》列为MZL二线治疗的II推荐方案。在一项奥布替尼治疗经治r/rMZL的多中心、开放标签II期研究中,90名患者每天1次接受150 mg奥布替尼治疗。试验中的大部分患者处于疾病晚期,其中IV期占比75.6%。在24.3个月中位随访期间,独立审查委员会(IRC)评估的ORR为58.9%,92.2%的患者观察到肿瘤缩小。中位DoR为34.3个月,中位PFS尚未达到,12个月的PFS率和OS率分别为82.8%和91.0%。奥布替尼整体耐受性良好。常见的全等级TRAEs包括贫血(27.9%)、中性粒细胞计数减少(23.4%)、白细胞计数减少(18.0%)、血小板计数减少(17.1%)、血尿(16.2%)、皮疹(14.4%)和上呼吸道感染(10.8%)。34名患者(30.6%)出现了≥3级TRAE,18名患者(16.2%)出现了严重TRAE,其中肺炎(5.4%)最为常见,7名患者(6.3%)因TRAE停药。
2、奥布替尼治疗MCL:即将向FDA提交上市申请,有望打开海外市场套细胞淋巴瘤(MCL)是由淋巴结滤泡套区B淋巴细胞恶性转化引起,大多数患者在确诊时处于晚期。尽管一线免疫疗法的反应率较高,多数患者仍会复发并需要后续治疗。截至目前,r/rMCL尚无标准疗法。FDA批准的疗法仍然有限,有CR率低、缓解时间短、老年患者的安全性和耐受性较差等问题。2023年5月,《Blood》子刊发表了奥布替尼治疗r/r MCL患者的临床研究结果。研究合计106名患者入组,截至2023年6月,中位随访时间47个月。当以传统的CT方法测量时,经研究者评估的ORR为83%,其中CR为35.8%,CRu为3.8%,PR为43.4%。患者实现快速应答。中位DOR与PFS分为别25.79个月和24.94个月,中位OS为56.21个月。在美国,针对r/rMCL的全球注册性II期临床试验的患者招募已于2023年上半年完成,公司预计将于2024年下半年提交NDA。此外,针对一线MCL患者,公司将启动一项随机、双盲、多中心的全球III期临床试验,试验方案以奥布替尼联合利妥昔单抗及苯达莫司汀头对头对比苯达莫司汀单药。
3、奥布替尼治疗CLL/SLL:一线适应症今年报产,进一步扩充市场空间慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)是最常见的白血病类型之一,是B淋巴细胞的一种惰性恶性肿瘤。全球每年有19.1万新确诊的CLL病例。奥布替尼单药二线治疗成人r/r CLL/SLL的适应症已经获批并进入医保。此适应症的获批是基于一项单臂、多中心、开放标签的II期研究(NCT03493217)。80名符合条件的中国患者接受了每天一次150 mg奥布替尼单药治疗。最终ORR达到92.5%,其中CR为21.3%,PR为60.0%,PR伴淋巴细胞增多为11.3%。在中位随访时间为32.3个月时,受试者30个月的PFS率和OS率分别为70.9%和81.3%。BTK抑制剂一线治疗CLL/SLL能够使患者获得长期生存获益,老年患者预期寿命已接近正常人。一线患者用药时间长达8-9年,市场潜力巨大。在国内,泽布替尼及伊布替尼已获批一线适应症,奥布替尼将于2024年下半年递交NDA。此前,泽布替尼在III期临床SEQUOIA中头对头对比苯达莫司汀联合利妥昔单抗,实现mPFS的显著延长(HR 0.42),治疗组和对照组24个月PFS率达85.5% vs69.5%,24个月OS率达94.3% vs 94.6%,ORR为94.8% vs 85.3%。伊布替尼在III期RESONATE-2研究中,与苯丁酸氮芥头对头对比一线治疗CLL/SLL患者获益显著。ORR分别为86% vs 35%,经过长达10年的随访,患者中位PFS分别为8.9年和1.3年(HR0.16),伊布替尼组尚未达到中位OS,第9年时的OS率为68%。在伊布替尼持续治疗下,老年CLL患者总体生存率已接近同龄正常人群。
二)坦昔妥单抗:国内首款血液瘤CD19单抗,已申报上市
坦昔妥单抗(Tafasitamab)是一款靶向CD19的人源化单克隆抗体,包含Xencor公司独有的XmAb®工程化Fc结构域,因此显著强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过细胞凋亡和免疫效应机制介导B细胞肿瘤的裂解。
坦昔妥单抗联合来那度胺(TAFA+LEN)用于治疗不符合自体干细胞移植条件的r/r DLBCL已分别于2020年7月与2021年8月获得FDA及EMA批准上市。2021至2023年,坦昔妥单抗全球销售额分别为490万美元、1970万美元以及3710万美元。2021年8月,诺诚健华以3500万美元首付款、最高8250万美元里程碑付款与Incyte达成合作,获得坦昔妥单抗在大中华区的血液瘤和实体瘤开发和独家商业化权利。坦昔妥单抗联合来那度胺方案在美国的获批是基于一项名为L-MIND(NCT02399085)的II期临床试验的数据。该试验纳入80名患者,全部患者既往接受过≥1种但不超过3种疗法,其中需要包括≥1种抗CD20疗法(如利妥昔单抗)。结果显示,TAFA+LEN方案的ORR达到57.5%,DOR为3.7年。在中位随访33.9个月后,中位PFS为11.6个月;在中位随访42.7个月后,中位OS为33.5个月。在除CD19 CAR-T之外的靶向疗法中TAFA+LEN疗效突出。
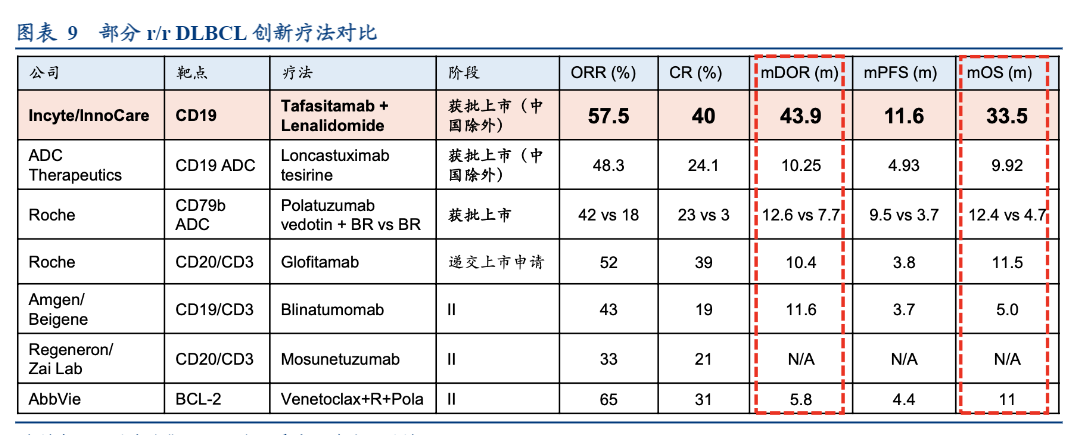
坦昔妥单抗联合来那度胺已在香港获批治疗符合条件的DLBCL患者。得益于博鳌乐城国际医疗旅游先行区和粤港澳大湾区的政策,坦昔妥单抗联合来那度胺已分别在瑞金海南医院和广东祈福医院开出处方。2024年6月20日,中国国家药品监督管理局已受理坦昔妥单抗联合来那度胺治疗不适合自体干细胞移植条件的r/rDLBCL的上市申请,并纳入优先审评,目前已启动III期确证性试验。
(三)ICP-248:安全性更优的BCL-2抑制剂,联用奥布替尼潜力巨大
ICP-248是一款新型口服高选择性BCL2抑制剂,BCL2是细胞凋亡通路的重要调控蛋白,其表达异常与多种恶性血液肿瘤的发生发展相关。BCL-2抑制剂通过激活导致癌细胞快速凋亡的内源性线粒体凋亡途径而显示出抗肿瘤作用。
ICP-248具有更高的代谢稳定性和更少的药物与药物相互作用(DDI),与奥布替尼联用将可能克服现有BCL-2抑制剂的耐药性,有望用于治疗CLL/SLL和其他NHL。
ICP-248在中国大陆地区的I期临床试验正在进行,这是一项开发性、多中心的I期剂量爬坡和剂量拓展试验,旨在评估ICP-248在中国r/r B细胞恶性肿瘤(主要包括r/rCLL/SLL及r/r MCL与其他NHL)中的安全性及初步有效性。初步结果显示,ICP-248具有优于其他BCL-2抑制剂的良好安全性,以及相对低剂量高暴露量下良好的PK数据。截至目前,已完成对17例患者的给药,在6例100 mg QD RP2D剂量下给药的可评估患者中,3例达到CR且其中2例实现微小残留病灶阴性(uMRD),ORR达到100%。
ICP-248与奥布替尼联用一线治疗CLL/SLL的临床试验已于2024年3月在中国获批,并于5月20日完成首例患者入组。2024年1月,ICP-248单药临床I期试验获得FDA批准。
(四)CM355:CD3×CD20双抗皮下剂型疗效积极
双特异性T细胞结合器(Bispecific T Cell Engager,BiTE,又名双特异性T细胞重定向抗体)是最常见的双抗设计之一,通常选择一端靶向特定的肿瘤相关抗原,另一端靶向T细胞受体(TCR)复合物中的CD3链。通过同时靶向这两个靶点能够诱导靶向T细胞介导的识别肿瘤细胞杀伤作用。CD20是血液瘤治疗中的热门靶点,在多种B细胞淋巴瘤中表达。多款CD3×CD20双抗已被开发用于靶向治疗B细胞淋巴瘤。
ICP-B02是诺诚健华与康诺亚共同开发的一款用于治疗B细胞NHL的CD20×CD3双特异性抗体,处于临床I/II期阶段。截至2024年3月28日,ICP-B02静脉输注(IV)制剂的爬坡已经完成,皮下(SC)制剂正在进行患者评估。IV制剂与SC制剂的初步数据均显示ICP-B02对于FL患者与DLBCL患者具有良好的疗效。不论给药方式,所有接受6mg及以上剂量治疗的13例患者均实现应答,ORR达到100%。在SC制剂组中的9例可评估患者中,CRR达到77.8%(7/9),其中2例DLBCL患者达到CR。试验中的多数应答患者仍在持续接受治疗并持续应答。
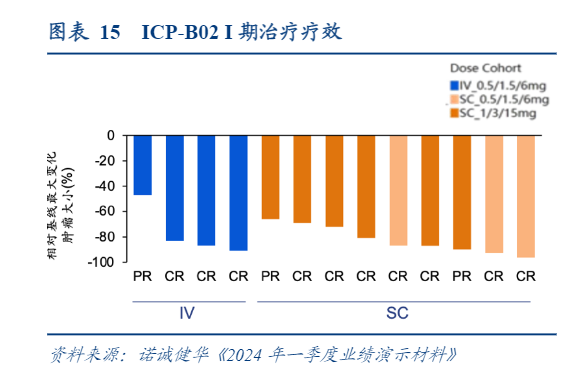
ICP-B02皮下注射展现出良好的线性PK,因此公司选择了皮下注射剂型进行进一步开发。基于ICP-B02单药的积极数据,诺诚健华计划在NHL患者的前线治疗中进行ICP-B02联合其他免疫化疗的剂量扩展研究,IND申请已于2024年3月提交
(五)ICP-490:新一代分子胶,临床前展现抗肿瘤活性
诺诚健华-U(688428)深度研究报告证监会审核华创证券投资咨询业务资格批文号:证监许可(2009)1210号14(四)CM355:CD3×CD20双抗皮下剂型疗效积极双特异性T细胞结合器(Bispecific T Cell Engager,BiTE,又名双特异性T细胞重定向抗体)是最常见的双抗设计之一,通常选择一端靶向特定的肿瘤相关抗原,另一端靶向T细胞受体(TCR)复合物中的CD3链。通过同时靶向这两个靶点能够诱导靶向T细胞介导的识别肿瘤细胞杀伤作用。CD20是血液瘤治疗中的热门靶点,在多种B细胞淋巴瘤中表达。多款CD3×CD20双抗已被开发用于靶向治疗B细胞淋巴瘤。图表13CD3双抗作用机制图表14CD3×CD20双抗竞争格局药物公司全球进度epcoritamab-byspGenmab/艾伯维批准上市格菲妥单抗Roche批准上市莫妥珠单抗Biogen/罗氏批准上市odronextamabRegenero/再鼎医药申请上市plamotamabXencor/诺华/强生II期CM355康诺亚/诺诚健华I/II期EX103爱思迈I/II期GB261嘉和生物/Ab StudioI/II期MBS303天广实I/II期imvotamabIGMI/II期JS203君实生物I期SCTB35神州细胞I期TQB2825正大天晴I期资料来源:AjitSinghet al., Overcoming the challenges associated with CD3+ T-cell redirection in cancer资料来源:医药魔方数据库,华创证券整理ICP-B02是诺诚健华与康诺亚共同开发的一款用于治疗B细胞NHL的CD20×CD3双特异性抗体,处于临床I/II期阶段。截至2024年3月28日,ICP-B02静脉输注(IV)制剂的爬坡已经完成,皮下(SC)制剂正在进行患者评估。IV制剂与SC制剂的初步数据均显示ICP-B02对于FL患者与DLBCL患者具有良好的疗效。不论给药方式,所有接受6mg及以上剂量治疗的13例患者均实现应答,ORR达到100%。在SC制剂组中的9例可评估患者中,CRR达到77.8%(7/9),其中2例DLBCL患者达到CR。试验中的多数应答患者仍在持续接受治疗并持续应答。图表15ICP-B02 I期治疗疗效图表16ICP-B02血液浓度-时间曲线半对数图资料来源:诺诚健华《2024年一季度业绩演示材料》资料来源:诺诚健华《2024年一季度业绩演示材料》诺诚健华-U(688428)深度研究报告证监会审核华创证券投资咨询业务资格批文号:证监许可(2009)1210号15ICP-B02皮下注射展现出良好的线性PK,因此公司选择了皮下注射剂型进行进一步开发。基于ICP-B02单药的积极数据,诺诚健华计划在NHL患者的前线治疗中进行ICP-B02联合其他免疫化疗的剂量扩展研究,IND申请已于2024年3月提交。(五)ICP-490:新一代分子胶,临床前展现抗肿瘤活性泛素-蛋白酶体系统(UPS),即泛素介导的蛋白降解系统,是细胞调节蛋白质水平的主要途径,参与细胞内80%以上受损或不再需要的蛋白质的降解。泛素分子能在一系列酶的作用下选出靶蛋白分子并对其进行特异性修饰,最后指导靶蛋白在蛋白酶处被降解成为短肽或氨基酸。E3泛素连接酶能在靶蛋白上形成聚泛素链,是UPS系统识别被降解蛋白的关键。分子胶通常是小分子,通过改变靶蛋白或E3泛素连接酶的构象,促使它们相互作用,形成复合物,并最终达到抑制靶蛋白活性或直接将其降解的目的。ICP-490是创新的下一代口服CRBN E3连接酶调节剂,是一种免疫调节剂(IMiD),通过与CRL4CRBN-E3泛素连接酶复合物的底物受体CRBN特异性结合,诱导IKZF1(Ikaros)和KZF3(Aiolos)等转录因子的泛素化降解。在体内药效研究中,ICP-490在MM和DLBCL异种移植模型中展现出良好的抗肿瘤作用。ICP-490在体外和体内药效研究中克服了对前几代CRBN调节剂的获得性耐药。此外,ICP-490通过增强ADCC活性,在临床前研究中与CD38抗体daratumumab展现出了协同作用,为临床联合治疗提供了科学依据。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)