2024创新药行业报告:ALK抑制剂市场新突破
本周创新药重点关注
ALK突变NSCLC
肺癌是全球范围内发病率和病死率最高的恶性肿瘤,其中非小细胞肺癌(NSCLC)占比超过80%。EGFR、KRAS、ROS1、BRAF、HER2、RET等驱动基因突变是NSCLC发生和维持的主要原因之一,临床上针对不同的驱动基因已开发对应的靶向药物。
间变性淋巴瘤激酶(ALK)阳性是NSCLC的一种驱动基因突变,患者体内的EML4基因外显子会与ALK基因外显子融合,从而形成具有高度致癌性的EML4-ALK融合基因。ALK阳性NSCLC约占全部NSCLC的3%-7%,这类患者中有多达40%在确诊时伴有脑转移。ALK突变有很强的排他性,当它突变时,其他驱动基因往往不会发生变异。
ALK突变的NSCLC患者对ALK抑制剂的高度敏感性。目前,已有三代ALK抑制剂合计十款产品获批,其中一代ALK抑制剂克唑替尼于2013年在国内获批,第一个二代ALK抑制剂塞瑞替尼于2018年在国内获批。约50%的患者在接受目前可用的第一代或第二代ALK TKI治疗后出现耐药突变。
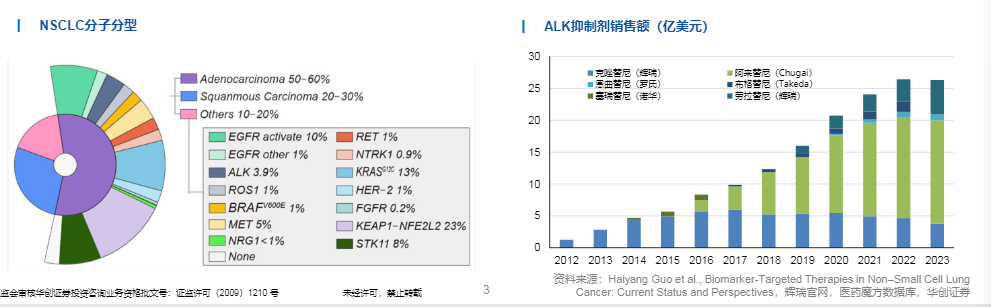
ALK抑制剂迭代克服上一代抑制剂耐药问题
克唑替尼(Crizotinib)是最早研发出来的ALK抑制剂,相较于铂类具有更优异的疗效。然而,经克唑替尼治疗的患者在治疗开始后的12个月内频繁出现耐药现象,且由于克唑替尼血脑屏障通过率低下,多数患者治疗复发后出现脑转移。
与克唑替尼相比,第二代药物(阿来替尼「Alectinib」、布格替尼「Brigatinib」、塞瑞替尼「Ceritinib」、恩沙替尼「Ensartinib」)与ALK位点的亲和力及血脑屏障通过性均有明显提高;然而,脑转移和耐药等情况仍不可避免。第三代药物洛拉替尼(Lorlatinib)具有独特的分子结构,具有更高的选择性和更强的中枢神经系统(CNS)渗透性,在第一、二代药物治疗失败的情况下,仍具有抗肿瘤活性。以NVL-655为代表的第四代药物可克服多种ALK耐药突变,目前已在针对ALK耐药NSCLC患者的I期试验中取得积极数据。
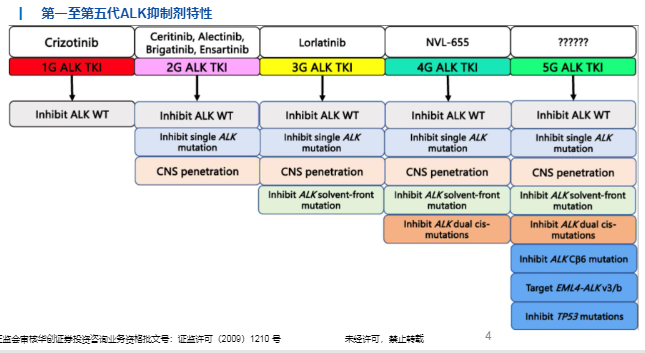
第一至第三代ALK抑制剂疗效对比
在Profile1014研究中,一代药物克唑替尼对ALK阳性NSCLC患者的ORR达到74.0%,mPFS为10.9个月,显著优于化疗组(P<0.01)。
第二、三代ALK抑制剂无论是作为克唑替尼治疗失败后的二线治疗选择还是作为一线治疗使用,均有良好的疗效。在作为一线疗法时,第二、三代药物均在头对头试验中击败克唑替尼,显著延长患者的mPFS至至少16个月,其中经阿来替尼治疗患者的mPFS高达34个月。
第三代ALK抑制剂洛拉替尼一线中位PFS超过5年
近期,辉瑞在2024ASCO大会上以口头报告的形式公布了III期CROWN研究的长期随访结果。这项研究旨在评估洛拉替尼(商品名:博瑞纳®)对比第一代ALK抑制剂克唑替尼在既往未经治疗的ALK阳性晚期NSCLC患者中的疗效。试验纳入296名患者,并按1:1比例随机分配,接受每天一次100mg洛拉替尼(n=149)或每天两次250mg克唑替尼(n=147)。
经过5年的中位随访,克唑替尼组mPFS为9.1个月,而洛拉替尼治疗组PFS仍未达到;试验观察到的风险比(HR)为0.19,即与克唑替尼相比,洛拉替尼将患者的疾病进展或死亡风险降低了81%。此外,洛拉替尼治疗组中有60%的患者5年后仍未见疾病进展或死亡,而对照组仅有8%。
响应率方面,洛拉替尼组与克唑替尼组ORR分别为81%vs63%,中位DoR分别为未达到vs9.2个月。
首药控股:第三代ALK抑制剂Ficonalkib展现BIC潜力
2024年2月29日,由首药控股自主研发的第三代ALKTKIFiconalkib(SY-3505) 的临床I/II期研究(NCT05257512)结果已发表在《胸部肿瘤学杂志》上。该I/II期研究是Ficonalkib在ALK阳性晚期NSCLC患者中的首次人体、开放标签、多中心研究。在2020年4月21日至2023年8月31日期间,试验纳入127名患者。
在I期研究入组的62名患者中,ORR为38.3%,DoR为9.23个月,PFS为6.11个月。85.5%的患者发生了TRAE,19.4%的患者发生了≥3级TRAE。
II期研究共入组65例患者,全部患者均至少接受过一种二代ALK抑制剂且治疗后发生疾病进展。接受II期推荐剂量(600mg, QD)治疗的患者共计88例,在80例疗效可评估的患者中,经研究者评估的ORR为47.5%,中位DoR为9.23个月,中位PFS为7.95个月。在基线伴可测量颅内病灶的32例患者中,颅内ORR为37.5%,中位DoR为9.20个月。Ficonalkib的吸收和耐受性良好,在800mgQD时发生了一次剂量限制性毒性事件。90.9%的患者发生了TRAE, 14.8%的患者发生了≥3级TRAE。TRAE导致的剂量中断和降低发生比例分别为15.9%和1.1%。3.4%的患者因TRAE永久停药,没有发生治疗相关死亡。
目前,Ficonalkib在二代ALK TKI耐药的ALK阳性NSCLC患者中的关键II期临床研究(NCT05869162)和在初治ALK阳性NSCLC患者中头对头克唑替尼的关键III期临床研究(NCT06254599)均在进行中。
2023年5月16日,Nuvalent公司宣布其在研脑渗透性ALK抑制剂NVL-655获得美国FDA授予的突破性疗法认定(BTD),用于治疗先前接受过两种或两种以上ALKTKI治疗的局部晚期或转移性ALK阳性NSCLC患者。
NVL-655获授BTD主要是基于其在ALKOVE-1试验I期部分的初步安全性及疗效结果。试验纳入的93名晚期ALK阳性NSCLC患者中,43名有ALK二次突变,其中单突变19例,复合突变24例。入组患者中位治疗线数3,在既往治疗中,44%服用过第一代ALK抑制剂克唑替尼,95%服用过第二代ALK抑制剂(多为阿来替尼),83%服用过第三代ALK抑制剂洛拉替尼。试验中,患者将分六个剂量队列(范围15mg-200mg,150mg为RP2D)接受每日一次NVL-655治疗。
截至2023年8月8日,在51位应答可评估的患者中,ORR达39%,其中具有CNS转移史患者的ORR达到52%,带有任何ALK耐药突变患者的ORR达54%。所有肿瘤部分缓解患者仍保持疾病稳定,最长已超过1年。另外,仍有67%(34/51)患者继续服用NVL-655,中位治疗持续时间3.4个月,中位反应时间为6.1周。
安全性方面,NVL-655的耐受性良好,仅有2%患者因TRAE停止接受治疗,5%的患者因TRAE降低剂量。
目前,ALKOVE-1试验正在进行II期部分的研究,入组患者包括未经ALKTKI治疗的一线ALK+ NSCLC患者以及经过1-3线治疗的患者,主要终点为ORR。
第二部分
国内创新药回顾
【基石药业】公司与欧洲医药公司Ewopharma达成商业化战略合作,将舒格利单抗(PD-L1单抗)在中东欧地区的商业化权利授予Ewopharma。根据许可及商业化协议协议,Ewopharma将获得舒格利单抗在瑞士以及18个中东欧国家(CEE)的商业化权利。这包括欧盟成员国保加利亚、克罗地亚等以及非欧盟国家阿尔巴尼亚、波斯尼亚等。根据许可及商业化协议的条款,基石药业将最高获得5130万美元的首付款以及后续注册和销售里程碑付款。基石药业将通过向Ewopharma及其附属公司销售产品来获取国际收入。Ewopharma将负责定价、报销、营销、分销等相关事宜,基石药业将负责供应产品并为相关品牌提供必要的培训和支持。
【海创药业】公司自主研发的PROTAC在研创新药物HP518的临床研究数据将于2024年ASCO年会上发布。HP518是公司自主研发一种口服、靶向蛋白降解嵌合体(PROTAC)药物,用于晚期前列腺癌(mCRPC)患者治疗
【百奥泰】1、公司宣布取得NMPA核准签发的《药物临床试验批准通知书》,公司在研药品BAT8008(TROP2ADC)联合贝伐珠单抗或联合BAT7104(PD-L1/CD47双抗)治疗晚期实体瘤的临床试验申请获得批准;2、公司与STADAArzneimittelAG签署授权许可与商业化协议,将公司的BAT2506(戈利木单抗)注射液在欧盟、英国、瑞士以及其他部分欧洲国家市场的独占的产品商业化权益有偿许可给STADA。首付款及里程碑款总金额最高至1.575亿美元,其中包括1000万美元首付款、累计不超过1.475亿美元里程碑付款,以及净销售额的两位数百分比作为收入分成。
【博安生物】公司自主研发的肿瘤领域地舒单抗注射液(120mg)—博洛加®已获NMPA批准上市,用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤,包括成人和骨骼发育成熟(定义为至少1处成熟长骨且体重≥45kg)的青少年患者。博洛加®是安加维(XGEVA®)的生物类似药。
【恒瑞医药】1、子公司福建盛迪医药有限公司收到NMPA核准签发关于HRS9531片的《药物临床试验批准通知书》,同意开展2型糖尿病和体重管理的临床试验。HRS9531片是以HRS9531为主要活性成分的具有全球自主知识产权的新型口服靶向抑胃肽受体(GIPR)和胰高血糖素样肽-1受体(GLP-1R)的双激动剂;2、公司收到NMPA核准签发关于SHR0302碱凝胶的《药物临床试验批准通知书》,申请适应症为白癜风,SHR0302碱凝胶是一种外用、高选择性的JAK1抑制剂;3、子公司上海恒瑞医药有限公司和苏州盛迪亚生物医药有限公司收到NMPA核准签发关于SHR-9539注射液的《药物临床试验批准通知书》,同意开展多发性骨髓瘤的临床试验;4、子公司山东盛迪医药有限公司和北京盛迪医药有限公司收到NMPA核准签发关于HRS-5346片的《药物临床试验批准通知书》,同意开展临床试验,申请的适应症为拟用于治疗脂蛋白紊乱。
【泽璟生物】公司于近日收到NMPA核准签发的《药物临床试验批准通知书》,盐酸吉卡昔替尼片(曾用名:盐酸杰克替尼片)用于治疗12岁及以上青少年和成人非节段型白癜风患者的II/III期临床试验获得批准。盐酸吉卡昔替尼是公司自主研发的一种新型JAK和ACVR1双抑制剂类药物,属于1类新药,公司拥有该产品的自主知识产权。
【荃信生物】公司自主研发QX005N(IL-4Rα单抗)注射液结节性痒疹(PN)III期临床试验(登记号:CTR20241660)达成首例患者入组。
【百利天恒】公司自主研发的创新生物药注射用BL-B01D1(EGFR×HER3-ADC)单药用于EGFR-TKI治疗失败的EGFR敏感突变的局部晚期或转移性非小细胞肺癌的III期临床试验已于近日完成首例受试者入组。截至目前,BL-B01D1单药治疗末线鼻咽癌、二线食管鳞癌、HR+HER2-乳腺癌的国内III期注册临床试验正处于受试者入组的阶段。
【药明巨诺】公司在2024欧洲风湿病学大会(EULAR2024)上公布了瑞基奥仑赛注射液(relma-cel)在中国成人活动性系统性红斑狼疮(SLE)患者中的最新临床数据。(摘要编号:3246;墙报编号:POS0054)。瑞基奥仑赛注射液是一款靶向CD19的自体CAR-T细胞免疫治疗产品。
【来凯医药】LAE002(afuresertib,一种口服AKT抑制剂)联合氟维司群针对PIK3CA/AKT1/PTEN改变的HR+/HER2-局部晚期或转移性乳腺癌(LA/mBC)在中国展开的III期临床试验AFFIRM-205已启动患者招募,并完成了首例患者入组。
【先声药业】盐酸达利雷生片治疗中国失眠患者的III期临床研究(NCT06010693)读出顶线数据,并达成主要终点。达利雷生是一种双重食欲素受体拮抗剂(DORA),可阻断促进觉醒的食欲素神经肽(食欲素A和食欲素B)与其受体结合。
【康方生物】公司自主研发的全球首创双特异性抗体新药依达方®(依沃西注射液,PD-1/VEGF)对比帕博利珠单药一线治疗PD-L1表达阳性(PD-L1TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性III期临床试验AK112–303(HARMONi-2),由独立数据监察委员会(IDMC)进行的预先设定的期中分析显示达到无进展生存期(PFS)的主要研究终点。
全球创新药速递
在2024ASCO会议上,诺华宣布Scemblix(asciminib)的关键性III期ASC4FIRST试验取得积极数据。分析显示,在新确诊的费城染色体阳性慢性髓系白血病慢性期(Ph+CML-CP)患者中,与研究者选择的标准治疗(SoC)酪氨酸激酶抑制剂(TKI)相比,Scemblix在第48周表现出更优的主要分子学缓解(MMR)。
Scemblix是一种针对ABL1的变构抑制剂,通过与ABL1的肉豆蔻酰口袋结合从而抑制BCR-ABL1的活性。由于它与BCR-ABL1结合的位点与靶向ATP结合位点的常见TKI不同,因此可能解决慢性髓系白血病(CML)患者后线治疗中对TKI耐药和不耐受的问题。美国FDA在2021年10月批准Scemblix上市,用于治疗CML的两种不同适应症。
ASC4FIRST试验达到双主要终点,结果具有临床和统计学意义。Scemblix治疗组与研究者选择的SoC TKI在第48周达到MMR的患者比例为67.7% vs 49.0%,Scemblix治疗组与伊马替尼单药治疗组相比,第48周达到MMR的患者比例分别为69.3% vs40.2%。与研究者选择的SoC TKI和伊马替尼单药相比,接受Scemblix治疗的患者还达到更深的分子学缓解(MR4和MR4.5)。
在新确诊患者中,Scemblix安全性特征与既往注册研究一致,未观察到新的安全性问题。与伊马替尼和第二代TKI相比,Scemblix显示出良好的安全性和耐受性,不良事件(AE)和停药率更低。5月31日,诺华公布了高度选择性的布鲁顿酪氨酸激酶(BTK)抑制剂remibrutinib治疗慢性自发性荨麻疹(CSU)的最新长期疗效和安全性数据。
在关键的III期研究REMIX-1(n=470)和REMIX-2(n=455)中,对于使用第二代H1-抗组胺药仍有症状的CSU患者,每日两次服用25mgremibrutinib在治疗早期表现出显著的症状改善,且改善可持续到第52周。诺华计划将于2024年下半年开始向全球卫生局提交remibrutinib针对CSU适应症的上市申请。
REMIX-1和REMIX-2主要终点是第12周每周荨麻疹活动评分(UAS7)以及每周瘙痒严重程度评分(ISS7)和每周荨麻疹严重程度评分(HSS7)相对于基线的绝对变化。最新披露的数据显示:接受remibrutinib治疗的患者最早在第1周就观察到UAS7有所改善。第52周评估显示,几乎一半的患者完全没有瘙痒和荨麻疹(UAS7=0)。
安全性方面,在长达1年的时间内,remibrutinib表现出良好且一致的安全性。在为期24周的安慰剂对照期间,remibrutinib与安慰剂在不良事件(AE)方面情况相当(包括严重不良事件和因不良事件而中断治疗)。此外,暴露调整后的不良事件发生率并没有随着长期治疗而增加。Remibrutinib治疗组和安慰剂治疗组的肝脏转氨酶升高情况均衡;所有转氨酶升高均为无症状、一过性和可逆性。研究人员认为所有严重不良反应均与研究药物无关。
该试验的详细数据将于2024年欧洲过敏和临床免疫学学会(EAACI)大会上公布。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)