2024生物医药行业报告:肾病创新药物商业化与企业发展
1. 管理层经验丰富,商业化稳步推进
1.1孵化于康桥资本,高管团队功底扎实
云顶新耀是一家全球领先的生物制药公司,专注于创新药领域的研发和商业化。产品管线聚焦于肾科疾病、感染性疾病、自身免疫性疾病、mRNA平台等领域。耐赋康、依拉环素等药品已获批上市,有望逐步释放业绩。2020年港股上市后,公司组建专业高效的商业化团队,以加速产品在大中华区及其他亚太市场的商业化进程。
云顶新耀孵化于康桥资本,后者是亚洲领先的私募股权基金,资金实力雄厚。2020年IPO完成后康桥资本累计持股比例为48.42%;截至2023年年报,累计持股比例为40.50%。

高管团队功底扎实、经验丰富。云顶新耀的管理团队在中国及全球制药企业从事过高质量研发、临床开发、药政事务、化学制造与控制(CMC)、业务发展、运营和商业化,拥有深厚的专长和丰富的经验。现任CEO罗永庆先生于2022年9月加入,拥有超过25年的医药健康行业从业经验,曾任吉利德科学全球副总裁兼中国区总经理,成功领导了八款创新药在中国的临床开发、注册获批和商业化上市,并迅速扩大了对中国患者的可及性。何颖、Dr.Jason Brown、梁旭、杨炜、曾庆雯等高管成员拥有20余年从业经验,曾任职于全球头部医药企业/研究所、医药投资公司等。
1.2构建差异化产品管线,多款产品逐步商业化
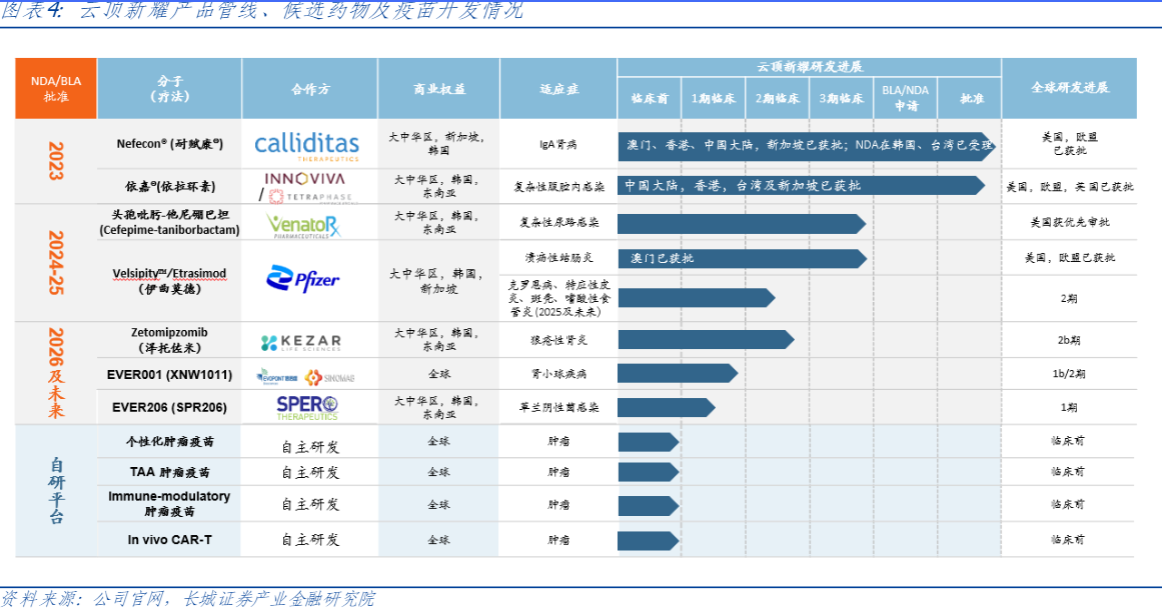
肾病+感染驱动收入增长,自主研发聚焦肿瘤治疗性疫苗。云顶新耀通过License-in和自主研发相结合的模式,瞄准高潜力、低竞争赛道,搭建差异化产品管线。目前用于治疗IgA肾病的耐赋康、用于治疗复杂腹腔内感染的依拉环素已在全球多个国家和地区上市,2023年合计贡献收入1.2亿元。2024年5月,伊曲莫德溃疡性结肠炎适应症澳门地区顺利获批,公司计划年内向CDE递交伊曲莫德及另一抗生素产品头孢吡肟-他尼硼巴坦的NDA申请,两款产品有望在2025-2026年于大陆地区实现商业化。自主研发平台聚焦于mRNA肿瘤治疗性疫苗,下半年即将启动临床研究。
1.3收入有望稳定增长,扭亏为盈指日可待
新药持续贡献业绩,规模发展助推公司扭亏为盈。2023年云顶新耀实现营业收入1.26亿元,同比增加1.13亿元,主要系依拉环素、耐赋康等产品上市销售。其中依拉环素收入9900万元,耐赋康收入2100万元。2023年净亏损为8.44亿元,同比增加5.97亿元。2022年净亏损为2.47亿元,主要是系Trodelvy®交易贡献了13.22亿元利润,若剔除该交易,则2023年净亏损同比收窄7.25亿元。目前公司有4款已上市及近期将上市产品,中短期内收入增长确定性高。
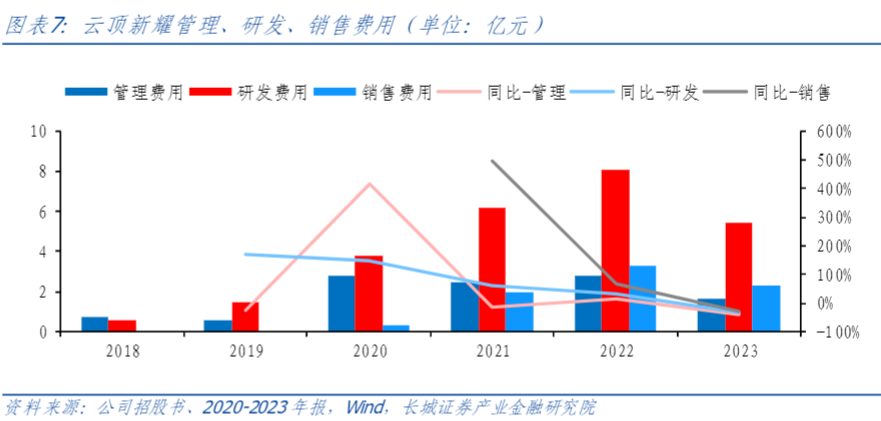
根据公司最新预期,4款新品有望助力达成100亿元峰值年销售规模。研发和运营效率逐步提升,费用支出不断优化。2023年管理费用1.65亿元,同比减少1.11亿元,主要系组织架构优化所致;研发费用5.40亿元,同比减少2.70亿元,主要系多款产品进入商业化;销售费用2.31亿元,同比减少9527万元,主要系商业化团队效率提升。我们认为随着收入稳健增长、规模优势显现,公司扭亏为盈指日可待。
2. 肾病:以肾小球类疾病为焦点,持续拓宽产品管线
在肾病领域,云顶新耀以肾小球类疾病为焦点建立产品管线,拳头产品耐赋康是治疗IgA肾病的首款创新药,现已在美国、欧盟、中国澳门等地上市,并于2024年5月14日登陆中国大陆。同时公司持续通过内部发现和授权引进扩大管线,泽托佐米、EVER001等管线正在持续推进中。
2.1IgA肾病患者基数庞大,亚裔人群患病率更高
慢性肾病(CKD),也被称为慢性肾衰竭,是指肾脏结构或功能异常且对健康有影响,持续时间超过3个月。CKD患者肾小球滤过率下降,通常出现以下一种或多种肾损伤标志:白蛋白尿、尿沉渣异常、肾小管相关病变、组织学异常、影像学所见结构异常或肾移植病史。CKD临床依据肾功能的受损程度,分为1-5期,用以评估疾病进展情况。CKD临床分期标准为肾小球滤过功能状态,与细分疾病和病因无关。
根据肾脏损伤的病因不同,CKD可分为原发性肾病和继发性肾病两大类。原发性肾病指一类原发于肾脏的独立疾病,引起肾脏损伤的具体原因尚无明确定论,较为公认的病因为与自身免疫功能紊乱相关。常见的原发性肾病有lgA肾病、膜性肾病等。继发性肾病的肾脏损伤由其他系统疾病引起,常见于糖尿病、高血压及系统性红斑狼疮等患者。继发性肾病主要包括糖尿病肾病、高血压肾病、狼疮肾病等。
CKD是全球常见慢性病,患者基数庞大。CKD患者规模在全球所有慢性疾病中排列第三。根据华盛顿大学卫生计量与评估研究所(IHME)估算,2019年全球约7亿CKD患者,为糖尿病患者数的约1.5倍,预计未来10年内仍将持续增长。中国CKD患者数量居全球首位,约1.25亿,占全球比例约18%。流行病学调查显示,中国成人CKD患病率为10.8%,并预计会进一步增长,直至发达国家水平,主要原因为老龄人口数量增长、糖尿病及高血压等CKD风险因素疾病患病率升高。
gA肾病是全球最常见的原发性肾小球疾病,并且具有明显的地域差异。根据艾昆纬发布的《慢性肾病白皮书》,一项基于多个国家肾活检样本的回顾性研究表明,IgA肾病年发病率约为2.5每十万人口,由于可能存在部分亚临床病例未被记录等原因,IgA肾病真实发生情况或更为常见。IgA肾病发病率具有显著的地域与人种相关性,东亚人种发病率远高于欧美。
在中国经病理诊断的原发性肾小球肾病患者中,IgA肾病患者占比约53%,显著高于其他国家,如亚洲其它国家IgA肾病占比大于28%,美国占比约27%、非洲摩洛哥仅12%。其余原发性肾病为膜性肾病MN、微小病变肾病MCD、局灶节段性肾小球硬化FSGS、系膜增生性肾炎等。
根据艾昆纬发布的《慢性肾病白皮书》,从全球结构来看,综合多项研究数据,中国IgA肾病患病率约为欧洲1.5-2倍,为美国3-6倍。基于最新欧洲十国IgA肾病患病率2.53每万人口,估算中国IgA肾病患者人数约500万。
发病原理:IgA肾病发病机制尚未完全明了,现被广泛接受的是IgAN四重打击假说,该假说认为IgAN患者循环中半乳糖缺乏的IgA1(galactose-defic ient IgA1,Gd-IgA1)水平增高,Gd-IgA1作为自身抗原诱发了自身抗体的产生,Gd-IgA1与自身抗体结合形成免疫复合物(immune complex,IC)并沉积于肾小球系膜区,沉积的IC通过激活补体,诱发炎性因子释放等多种途径最终导致肾脏损伤。
治疗原则:对于IgA肾病,现KD IGO指南及中国临床处方行为均选择RAS抑制剂作为一线治疗方案,若疾病仍快速进展,则使用激素类药物(如糖皮质激素)作为二线方案强化冲击治疗。有研究表明,现有治疗方案治疗后,患者仍在预期寿命前进展至终末期肾病,其中亚裔患者疾病进展更加快速。二线药物存在激素不良事件发生率高、停药后病情易复发、药物副作用早于疗效出现等问题。随着耐赋康获批并顺利商业化,公司预计KDIGO指南有望于年内更新,新指南有望推荐耐赋康用于蛋白尿>0.75g/天的所有患者。
创新药研发火热,有望助力于简化治疗流程、提高疗效。目前全球在研创新药物均布局IgA肾病二线治疗,热门靶点如B细胞清除机制和补体抑制剂竞争激烈,因此全新且有效的药物机制将成为厂家破局的关键所在。
2.2耐赋康:首款实现商业化的IgA肾病创新药,积极筹备医保谈判
耐赋康是一种新型口服布地奈德肠溶胶囊,其专为IgA肾病患者研制,迟释胶囊含布地奈德4mg,通过特殊的制作工艺,将布地奈德靶向释放于回肠末端的黏膜B细胞(包括派尔集合淋巴结),胶囊溶解后,三层包衣微丸持续稳定释放布地奈德,高浓度覆盖整个靶区域,从而减少诱发IgA肾病的半乳糖缺陷的IgA1抗体(Gd-IgA1)产生,进而干预发病机制上游阶段,达到治疗IgA肾病的作用。耐赋康于2023年11月获得中国国家药监局批准用于治疗原发性IgA肾病,并于2024年5月在中国内地上市。
耐赋康作为全球首款获批的IgA肾病特效药,产品特殊工艺使其能直达病区;降低蛋白尿和延缓eGFR下降作用显著;使用后安全性良好。考虑到积极的临床结果,最新的治疗指南有望将耐赋康纳入一线治疗方案,成为所有患者可使用的特效药。
(一)肠溶胶囊设计,药物直达病区。耐赋康是一种迟释的布地奈德胶囊,经过门静脉循环时基本无活性,故而能最大限度地减少全身糖皮质激素相关的副作用风险。同时布地奈德直达病区后靶向释放,能够更精准、更高效的发挥作用。
(二)全球临床III期结果积极。耐赋康是第一个在IgA肾病III期临床研究中确证具有降低蛋白尿和延缓eGFR下降作用的治疗方案。同时,也是第一个针对疾病源头的治疗方案,表明肠道黏膜免疫在IgA肾病发病中的具有关键作用。
对eGFR具有明显的治疗获益:治疗9个月时,与基线相比,Nefecon组eGFR平均升高0.66mL/(min·1.73m2),而安慰剂组下降4.56mL/(min·1.73m2);2年研究期结束时,Nefecon组eGFR自基线平均下降6.11ml/(min·1.73m2),而安慰剂组自基线平均下降12.00ml/(min·1.73m2),对应2年eGFR总斜率的组间差异为每年2.95mL/(min·1.73m2)(P<0.0001),提示9个月的Nefecon治疗在随访2年时可显著延缓肾功能衰退达50%。
无论基线时尿蛋白肌酐比(UPCR)水平如何(≥1.5g/g或<1.5g/g),Nefecon延缓肾功能衰退的获益保持一致。对蛋白尿具有明显的治疗获益:在2年时,Nefecon治疗组UPCR与基线相比降低30.7%,而安慰剂组仅降低1%,这与治疗9个月时结果相一致(Nefecon治疗组与安慰剂组UPCR降幅分别为33.6%和5.2%),最大降幅在第12个月达51.3%。这提示在治疗9个月之后即使停药15个月,仍观察到Nefecon治疗组尿蛋白保持降低的效果。
镜下血尿患者比例显著下降:在研究观察随访期,耐赋康治疗组镜下血尿的患者比例从基线的66.5%降至40.5%,而安慰剂组仅从基线的67.8%降至61.2%。镜下血尿患者比例在两组间的比值比为0.4(OR[95%CI]:0.4[0.2-0.6], p=0.0001),即经9个月的耐赋康治疗,在之后15个月的随访期间,与安慰组相比,耐赋康组患者伴有镜下血尿的风险减少60%。
安全性符合预期:在两项随机安慰剂对照试验中,9个月的Nefecon 16mg/d治疗的总体耐受性良好,其安全性与局部作用口服布地奈德产品的预期一致。NefIgArd研究A部分显示Nefecon治疗中出现的不良事件(TEAE)主要为轻度或中度,而且可逆,只有1%的严重不良事件。
(三)中国亚组数据表现优于全球。在肾功能保护、蛋白尿下降和镜下血尿改善等方面,耐赋康临床III期结果中中国亚组数据比全球研究中数值上更好的疗效,同时亦观察到在仅使用支持性治疗的中国患者对照组更快速的疾病进展。
eGFR:中国人群中,治疗9个月时,耐赋康组eGFR的平均绝对值变化较基线略有增加,为0.46ml/(min·1.73m2),而安慰剂组的eGFR较基线明显下降,为-6.93ml/(min·1.73m2)。在24个月时,耐赋康组eGFR下降了7.09ml/(min·1.73m2),而安慰剂组的eGFR下降了20.97ml/(min·1.73m2)。这表明,在2年期间(9个月治疗期和停止试验用药观察15个月),耐赋康治疗的患者肾功能恶化程度较安慰剂减少了约66%,这一数值在全球人群约为50%。
UPCR:在2年研究期间观察到耐赋康治疗持久降低蛋白尿。与安慰剂相比,9个月的耐赋康16mg/d治疗分别在9个月和24个月时使UPCR降低31%和43%,而全球人群在9个月与24个月时UPCR约下降30%。另外,在安慰剂组,中国人群在24个月时的平均UPCR自基线上升了18.6%,而全球人群却有轻微的下降,这也说明了中国人群的疾病进展相较于全球人群更快。
镜下血尿:在中国人群中,与基线相比,耐赋康组2年内无镜下血尿的患者比例从26.9%显著改善至57.7%,而安慰剂组几乎无变化。与安慰剂组相比,耐赋康治疗组24个月时无镜下血尿的患者比例明显更高。
2.3泽托佐米:正在开展临床II期试验,有望成为FIC药物
泽托佐米是一种新型、同类首创、选择性免疫蛋白酶体抑制剂,用于包括狼疮性肾炎、系统性红斑狼疮在内的自身免疫性疾病。该产品于2023年9月获得Kezar Life Sc iences的授权。2024年2月国家药监局(NMPA)批准了公司关于泽托佐米在中国的新药临床研究审批申请。公司将与合作伙伴共同推进全球性、安慰剂对照2b期临床试验PALIZADE项目,评估两种剂量水平的泽托佐米在活动性狼疮性肾炎患者中的疗效和安全性。
治疗范围广、安全性好。泽托佐米可以调节先天免疫和获得性免疫反应,从而降低炎症对器官造成的损伤,这一特性使其具有治疗多种自身免疫性疾病的潜力,且泽托佐米对免疫蛋白酶体的选择性抑制又可避免双重靶向蛋白酶体抑制相关的全身副作用。
全球临床II期结果积极。第25周(治疗结束)和第37周(即停药随访第12周)时,具有临床意义的总体肾脏缓解率(ORR)分别为64.7%和88.2%,完全肾脏缓解率(CRR)分别为35.3%和41.2%。
同时结果显示,尿蛋白肌酐比值(UPCR)分别较基线平均下降57.0%和83.0%,肾小球滤过率估计值(eGFR)在治疗期间保持稳定。研究期间,泽托佐米每周一次给药的用法表现出良好的安全性和耐受性,没有观察到免疫抑制作用,并且随访期内未发现其他安全性信号。
2.4EVER001(XNW001):临床I期试验进行中,有望成为肾病领域又一代表产品
EVER001胶囊(又名:XNW 1011)是新一代共价可逆的布鲁顿酪氨酸激酶(BTK)抑制剂,正在全球范围内开发用于治疗肾病。BTK是B细胞受体信号通路的重要组成部分,可调节B淋巴细胞的存活、激活、增殖和分化。应用小分子抑制剂靶向BTK是治疗B细胞淋巴瘤和自身免疫性疾病的有效选择。
中国抗体制药在国内完成的健康受试者I期研究结果表明,EVER001具有高选择性、优异的药代动力学特征、强大靶点参与性和良好的安全性特征,研究结果支持其进一步临床开发。根据与信诺维医药和中国抗体制药的独家许可协议,云顶新耀拥有在全球开发、生产和商业化EVER001用于治疗肾病的权利。2022年9月中国国家药品监督管理局(NMPA)药品审评中心批准了新一代共价可逆布鲁顿酪氨酸激酶(BTK)抑制剂EVER001胶囊(又名:XNW 1011)用于治疗肾小球疾病的Ib期临床试验(IND)申请。
计划中的Ib期临床研究将用于评价EVER001在蛋白尿为特征的肾小球疾病的中国患者中的安全性、疗效、药代动力学和药效学。肾小球疾病是导致慢性肾脏病(CKD)的常见原因。根据2021年9月与信诺维医药和中国抗体制药的独家许可协议,云顶新耀拥有在全球开发、生产和商业化EVER001用于治疗肾病的权利。中国抗体制药在中国健康受试者中进行的I期研究结果表明,EVER001具有高选择性、优异的药代动力学特征、良好的安全性特征以及强大的靶点参与性。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)