2024医疗保健行业报告:药明合联ADC市场领先者
1.药明合联:攻克无成药性靶点,专注肿瘤创新疗法
药明合联(Wuxi XDC)于2020年12月14日成立,是药明生物和合全药业成立的合资公司,专注于提供抗体偶联药物(ADC)等生物偶联药物、单克隆抗体中间体及与生物偶联药物相关的连接子及有效载荷的发现、工艺开发及GMP制造等端到端CRDMO服务,涵盖了从药物发现到GMP生产的全过程。公司整合小分子、生物大分子跨学科专业知识,筹建全球唯一的端到端ADC药物研发平台。按照截至2022年年底的项目数计算,公司是全球最大的生物偶联药物CRDMO。在高速增长的ADC药物市场,公司凭借领先的技术平台和持续提升的专业能力,高效、高质量的服务全球客户,获2023 World ADC奖"最佳CDMO 冠军"。
1.1.汇聚各方专业人才,卓越管理层经验丰富
股权结构集中,附属公司为一站式研发保驾护航。公司股权由药明生物技术直接持有60%、合全药业持有40%,股权结构集中。为了保障一站式服务,公司设立了如下附属公司:无锡药明合联生物技术(ADC原料药及ADC药品生产);上海药明合联生物技术(ADC的研究及工艺开发以及抗体的工艺开发及生产);常州药明合联生物技术(连接子及有效载荷的发现、工艺开发及生产);XDC Singapore(原料药及药物项目的发现及开发)。业务涵盖了一站式服务中客户对研发及生产服务的全部需求,简化CMC流程及供应链管理,为ADC上市保驾护航。
远见卓识的高级管理团队,在创新药领域深耕多年。公司核心团队成员在创新药领域拥有丰富的管理、研发及商业化经验,多人曾任职于全球知名的制药企业。首席执行官兼董事长李锦才博士,拥有二十余年生物制剂工艺开发、GMP生产方面经历,曾在基因泰克领导细胞培养和工艺研发工作。执行董事兼首席财务官席晓捷先生负责公司财务管理及战略发展,于美国及中国金融行业拥有超过18年的经验,曾在多家上市公司从事投资银行和私募股权投资业务。执行董事兼首席运营官张靖伟负责管理集团的供应链及营运,曾任美国辉瑞财务总监,在业务运营、供应链、销售及产品损益管理方面拥有超过20年经验。
经验丰富、具有才干的高级管理团队,持续专注于尖端技术及加强研发能力。公司拥有一批能力强且执行力强的员工。截止2023年9月30日,1110名员工中近半数拥有硕士或博士学位,并且大部分曾在中国或海外的制药或生物技术公司任职。
1.2.公司收入快速增长,后期项目收入占比持续提高
营收利润增长强劲,全球份额有望持续提升。公司凭借一站式CRDMO平台及丰富技术储备,2022年全球市场份额达9.8%,ADC外包服务收入位列全球第二、中国第一。公司2020至2022年营业收入由137.77百万元提升至1012.35百万元,CAGR为171.07%,2023H1公司实现收入1029.95百万元(yoy+196.04%);归母净利润由2020年26.30百万元增至2022年155.73百万元,CAGR为143.34%,2023H1归母净利润达177.21百万元(yoy+80.26%)。随着公司“赋能、跟随并赢得分子”策略进入成熟期,全球化品牌效应提升以及自有产能逐步释放,公司全球份额有望持续提升。
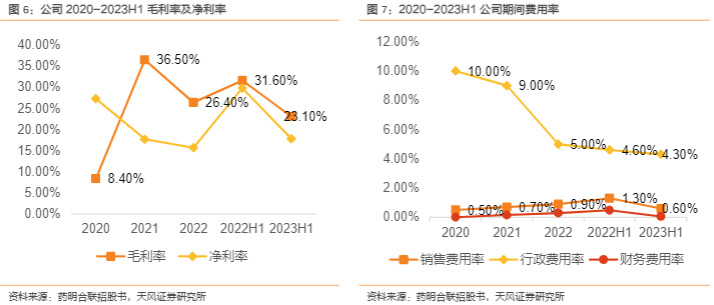
业务成熟度提升+自有产能释放,盈利能力有望修复。公司2020年至2022年毛利率分别为8.4%、36.5%和26.4%,2022H1和2023H1分别为31.6%和23.1%。公司2020年毛利率较低主要由于无锡基地设施建设与人才招聘产生大量直接人工成本与折旧摊销费用;随着业务规模的增长、产能效率提高,2021年毛利率有所提升;之后随着抗体中间体生产的外包成本占比增加,2022年及2023年H1的毛利率小幅下降。净利润方面,公司2020年至2022年净利率分别为27.3%、17.7%和15.7%,2022H1和2023H1分别为29.8%和17.8%,公司2022年后由于外包抗体中间体生产的间接生产成本与间接费用增加,净利率有所下降;随着公司自有产能的释放,净利率水平有望逐步提升。公司各项费用率处于较低水平,得益于母公司药明生物的品牌知名度,公司销售效率高于同行,2020至2022年销售费用率均低于1%,2023H1为0.6%;公司逐步提高运营效率,行政费用率由2020年的10.00%降至2023H1的4.3%。
临床项目服务比重升高,商业化制造前景可期。公司的生物偶联药物项目组合不同开发阶段,收益逐年快速增长:IND前项目(主要为药物发现及临床前开发阶段的项目)营收由2020年53.12百万元增长至2022年381.07百万元,CAGR为167.83%,2023H1营收371.27百万元(yoy+274.01%);而由于迅速增加的IND后项目(主要为临床及商业化阶段)合约价值更高,IND后项目营收由2020年的43.23百万元增长至2022年的609.35百万元,CAGR为275.44%,2023H1营收622.20百万元(yoy+170.32%)。IND后服务营收占比也由2020年的44.9%提升至2023H1的62.6%。截至2023H1,公司有67个IND前项目,IND后临床I、II、III期项目分别为27、11、5个,随着项目进程不断推进,公司预计不久后可启动商业化ADC生产项目,进一步驱动未来收入增长。
全球ADC服务市场需求攀升,海外公司营收占比逐年提高。公司客户群体广泛稳定且快速增长,主要分布于北美、中国及欧洲,国内客户带来的收入由2020年的68.69百万元增长至2023H1的356.02百万元,占比由71.3%降低至35.9%;来自北美与欧洲客户的营收份额快速增加,北美客户营收从2020年18.07百万元、占比18.7%增长至2023H1的367.71百万元、占比37.0%,欧洲客户营收从2020年0元增长至2023H1的229.78百万元、占比23.1%。伴随全球ADC市场需求的火热发展,公司凭借领先的CRDMO服务提供商地位,有望进一步提高海外市场份额。
2.ADCCRDMO市场持续扩容,行业已成为大众聚焦之选
2.1.ADC技术不断成熟,推动抗癌活性优化、治疗窗扩大
“ADC导弹”精确制导,高效“摧毁”肿瘤。抗体偶联药物(Antibody–drug conjugates,ADC)通过特定的连接子将具有高度靶向性的单克隆抗体(mAb)同具有细胞毒性的有效载荷偶联,可以选择性地将细胞毒性药物有效递送至癌细胞,从而降低脱靶毒性并改善治疗窗,被誉为肿瘤治疗的“魔法子弹”。ADC由确保特异性结合肿瘤细胞表面抗原的抗体、保证负载药物不会过早在血液中释放的连接子和可诱导肿瘤细胞凋亡的有效载荷三个关键部分组成。其中,抗体和靶点抗原的选择是决定药物适应症的关键,有效载荷决定了对肿瘤的杀伤效力,而连接子的稳定性影响了ADC的成药性。
研发助力ADC推陈出新,蓬勃发展。自1907年提出靶向肿瘤的偶联药物概念以来,ADC药物在百年内迎来了飞速的发展与变革。上个世纪50年代成功构建了首个用于白血病治疗的靶向肿瘤药物,标志着ADC发展史上重要的里程碑;70年代的新兴的杂交瘤技术可生产具有同质性和精准靶向的mAbs。2000年第一个获FDA批准的ADC药物—吉妥珠单抗奥唑米星(Mylotarg®)问世,用于治疗急性髓系白血病。随着抗体亲和力和大小的优化、连接子DAR的提高等技术的进步,ADC药物逐渐拓宽适应症范围应用于实体肿瘤。2013年曲妥珠单抗恩坦辛(T-DM1)首次获批用于晚期HER2+乳腺癌。截至2023年6月30日,共有15款ADC药物在全球范围内销售,其中自2018年以来获批准11款,自2021年以来获批准4款,超过1200条药物在研信息。
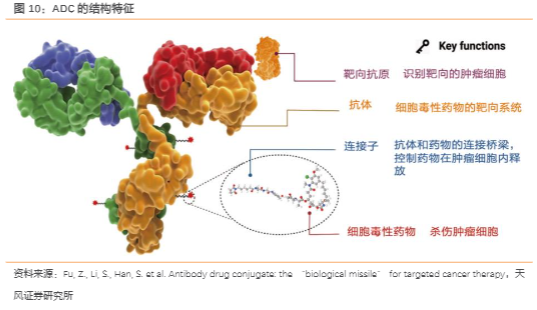
多重作用机制,“生物导弹”疗效。特异性mAb与靶向的细胞表面抗原结合,形成ADC药物和抗原的复合体,通过受体介导被肿瘤细胞内吞,形成被网格蛋白包裹的早期内体,随后成熟为晚期内体。经过溶酶体降解,细胞毒性药物被释放作用于细胞DNA、微管,引发细胞凋亡。如果药物具有高细胞膜穿透性,可扩散至邻近细胞引发旁观者效应,增强ADC疗效。ADC的抗体部分与免疫效应细胞相互作用,可以引发抗肿瘤免疫应答,包括细胞裂解依赖的细胞毒性作用(CDC)、抗体依赖的细胞毒性作用(ADCC)和抗体依赖的细胞吞噬作用(ADCP)。CDC效应通过抗体与补体C1q结合,随后C2-C9被激活,形成攻膜复合物裂解靶细胞;ADCC效应通过抗体的Fab段结合肿瘤细胞的抗原表位,Fc段与杀伤细胞(NK细胞、巨噬细胞等)表面的FcR结合,介导直接杀伤作用;ADCP效应通过单核细胞、巨噬细胞、嗜中性粒细胞和树突细胞表达的FcγRIIa(CD32a)、FcγRI(CD64)和FcγRIIIa(CD16a)介导吞噬肿瘤细胞,其中FcγRIIa是参与该过程的主要FcγR受体。此外,抗体部分还可特异性结合癌细胞表达的抗原,抑制抗原受体下游信号转导,从而抑制肿瘤生长。
经历三代技术变革,ADC不断扩大治疗窗。抗体工程、生物偶联技术、肿瘤特异性抗原靶点和肿瘤内细胞毒性药物的释放机制的研究促使ADC研发技术得以快速发展,ADC药物进入了黄金时代。第一代ADC采用鼠源抗体+高活性载荷+不稳定连接子+随机偶联策略,以吉妥珠单抗(Mylotarg®)和伊妥珠单抗(Besponsa®)为代表,然而其代谢不稳定,安全窗窄,成药挑战较高。第二代ADC采用人源化抗体+高活性载荷+稳定连接子+随机偶联策略,以维布妥昔单抗(Adcetris®)和恩美曲妥珠单抗(Kadcyla®)为代表,疗效和安全性有所提升,但是脱靶效应导致治疗窗较窄,高DAR导致的聚集和血浆清除过快成为了新一代ADC要重点解决的问题。第三代ADC采用全人源化抗体+高活性载荷+稳定连接子+定点定量偶联技术,以维泊妥珠单抗(Polivy®),维恩妥尤单抗(Padcev®),德曲妥珠单抗(Enhertu®)为代表。受益于位点特异性结合技术,第三代ADC药物DAR均一性良好,脱靶毒性弱且疗效佳。由第一三共和阿斯利康合作开发的靶向HER2药物德曲妥珠单抗(Enhertu®)用于治疗HER2+/Low表达/突变的实体瘤,被誉为多癌种战神,2022全年收入约15.56亿美元,同比增长217.5%。
2.2.ADC市场:投融资浪潮兴起,市场规模高速增长
即将突破百亿美元大关,ADC市场迎来全面增长。据弗若斯特沙利文数据,ADC全球市场规模自2017年的16亿美元上升至2022年的79亿美元,2018-2022 CAGR达40.4%,全球ADC市场有望在未来十年大幅增长,2022-2030年CAGR预计为30.0%,2030年全球ADC市场规模将达到647亿美元。相比之下,我国ADC药物市场起步稍晚,在2020年国家药监局批准首款ADC药物恩美曲妥珠单抗(Kadcyla®)后呈现快速增长趋势,预计未来市场规模将进一步扩大,2030年将升至689亿元,2022-2026E CAGR为109.2%。
ADC具备商业化潜力,开发变革推动投融资浪潮。2023年全球范围内的重大收购及授权交易频发,证明了ADC及其他生物偶联药物的商业化潜力。辉瑞以430亿美元收购ADC药物研发生产领导者Seagen,Seagen目前已有3个ADC药物获FDA批准上市,并已获得第四个ADC的开发许可。辉瑞预计到2030年Seagen的产品将每年为其增加100亿美元的风险调整收入。此前,吉利德210亿美元收购Immunomedics,从而获得戈沙妥珠单抗(Trodelvy®)的使用权,礼来以4.7亿美元收购ADC公司Emergence。中国作为世界ADC开发的领跑者,随着国内药企估值下降与海外并购可行性增加,国内医药行业并购市场或将迎来新的机遇,2022年至2023H110家中国药企与海外合作伙伴达成14项ADC对外授权交易,合共达220亿美元。
本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。