2024创新药行业报告:国产ADC与创新双抗研究进展
1.ASCO 2024:国产ADC精彩纷呈,创新双抗崭露头角
近年来,随着国内创新药行业的蓬勃发展,国内创新药领域创新成果频出,越来越多的国内创新药企业开始习惯在国际舞台发出自己的声音,国际主流学术会议成为国内创新药企业发布最新临床数据的主要选择。
在当前国内创新药企研发管线主要聚焦在肿瘤治疗领域的大背景下,肿瘤领域的重要学术会议成为国内创新药企业展示自身研发实力的重要平台,每年都会有多家企业在相关学术会议上公布自己取得的最新临床进展,关注研究相关学术会议的最新临床进展对创新药领域的研究具有重要意义。目前在全球范围内,每年有约二十余场肿瘤治疗领域的国际性学术会议召开。
从举办规模、全球影响力、学界认可度等多个维度分析,对中国医药企业来说,在这些学术会议中最重要的肿瘤学术会议当属ASCO(美国临床肿瘤学会年会)、ESMO(欧洲肿瘤内科学会年会)以及CSCO(中国临床肿瘤学会年会)等。ASCO 2024年会作为2024年内肿瘤治疗领域最大的国际会议之一,本次会议上国内外多个创新药企业披露了多个重要临床数据,在此我们梳理筛选出部分优异的临床数据进行分析,涉及多个ADC、双抗、小分子等的数据,从部分产品展现出的BIC/FIC潜力来看,目前国产创新药在不断取得新突破。
2.ADC:多个不同靶点ADC药物优异数据披露,国产ADC精彩纷呈
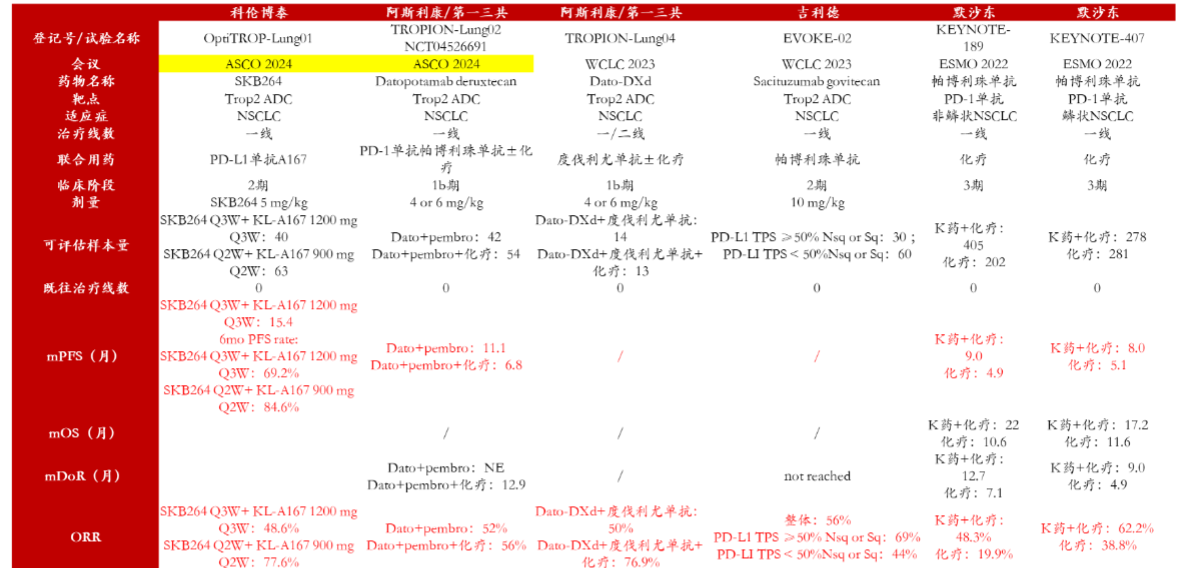
2.1.TROP2 ADC:科伦博泰SKB264联合PD-L1单抗NSCLC一线数据优异
本次ASCO 2024年会上科伦博泰公布了TROP2 ADC联合KL-A167(抗PD-L1单抗)用于一线治疗晚期非小细胞肺癌(NSCLC)患者的2期研究数据。临床数据:未曾接受过治疗的晚期无驱动基因突变NSCLC患者入组并按非随机方式每3周接受一次5 mg/kg剂量的芦康沙妥珠单抗(sac-TMT,SKB264)加每3周接受一次1200 mg剂量的KL-A167治疗(1A队列)或每2周接受一次5 mg/kg剂量的芦康沙妥珠单抗(sac-TMT)加每2周接受一次900 mg剂量的KL-A167治疗(1B队列),直至疾病进展或发生不可耐受毒性。截至2024年1月2日,1A队列和1B队列分别入组40名及63名患者。
中位年龄为63/63岁(1A/1B队列);97.5%/85.7%患者的美国东部肿瘤协作组体能状态(ECOG PS)评分为1分;根据IHC 22C3 pharmDx测定法,分别有30.0%/33.3%、32.5%/30.2%及37.5%/36.5%的患者肿瘤细胞的程序性死亡配体1(PD-L1)表达为< 1%、1%-49%及≥50%。
1A队列经过为期14.0个月的中位随访后,ORR为48.6%(18/37, 2例待确认),疾病控制率(DCR)为94.6%,中位PFS为15.4个月(95% CI: 6.7, NE),6个月PFS率为69.2%。1B队列经过为期6.9个月的中位随访后,ORR为77.6%(45/58, 5例待确认),DCR为100%,未达到中位PFS,6个月的中位PFS率为84.6%分析:EGFR野生型NSCLC一线治疗中,SKB264在SKB264 Q3W+ KL-A167 1200 mg Q3W剂量组下实现15.4个月的mPFS,非头对头比较优于包括其他ADC在内的其他药物的历史数据,数据表现优异;此外,SKB264 Q2W+ KL-A167 900 mg Q2W剂量组6个月PFS率高于SKB264 Q3W+ KL-A167 1200 mg Q3W,表明在高剂量情况下有望得到更好的生存数据,未来SKB264一线治疗值得期待。
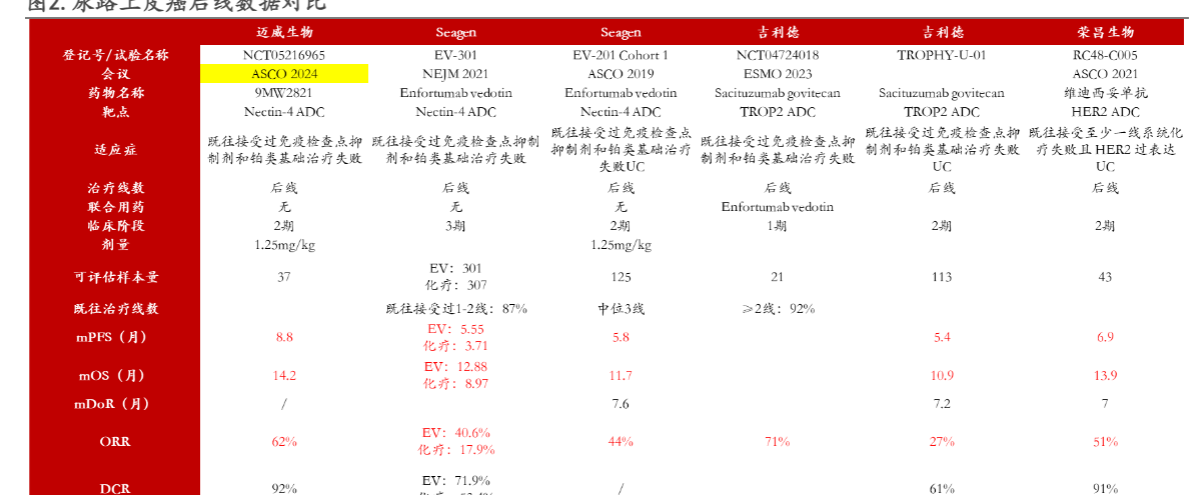
2.2.NECTIN-4 ADC:迈威生物9MW2821 UC、ESCC、CC、TNBC多个瘤种数据优异
本次ASCO 2024年会上迈威生物以口头报告形式展示了靶向Nectin-4 ADC 创新药(9MW2821)在尿路上皮癌、宫颈癌、食管癌、三阴性乳腺癌等多种晚期实体瘤的临床数据。临床数据:截至2024 年4 月1 日,在II 期临床1.25mg/kg 剂量组的240 例患者中:安全性数据方面,截至目前,1.25mg/kg 剂量组240 例患者中,最常见的治疗相关不良事件和≥3 级治疗相关不良事件是白细胞计数降低(50.8%, 23.3%),中性粒细胞减少(46.3%, 27.9%),贫血(43.8%, 8.3%),天门冬氨酸氨基转移酶升高(42.1%, 2.9%),丙氨酸氨基转移酶升高(35.4%, 2.1%),虚弱(32.1%, 2.9%),皮疹(30.0%, 5.0%),食欲减退(28.8%, 1.3%),恶心(26.7%, 0%),高血糖症(25.4%, 2.1%),血小板计数降低(24.2%, 4.6%),脱发(24.2%, 0%),感觉减退(22.5%, 1.7%),便秘(21.3%, 0%),呕吐(20.9%, 1.3%),高甘油三酯血症(20.4%, 2.1%),γ谷氨酰氨基转移酶升高(15.8%, 5.4%)。数据表明9MW2821 具有可控的安全性。
(1)尿路上皮癌(UC):37 例可评估疗效的患者中,客观缓解率(ORR)和疾病控制率(DCR) 分别为62.2% 和91.9%,中位无进展生存期(mPFS) 为8.8 个月,中位总生存期(mOS) 为14.2 个月。
分析:在经过IO和铂类化疗治疗的尿路上皮癌患者中,9MW2821实现了8.8个月的mPFS和14.2个月的mOS,非头对头对比同类产品显示出BIC潜力,未来海外授权及放量前景值得期待。安全性方面,240例患者中发生率>5%的≥3 级治疗相关不良事件是白细胞计数降低(23.3%),中性粒细胞减少(27.9%),贫血( 8.3%),皮疹(5.0%),γ谷氨酰氨基转移酶升高(5.4%),主要为血液性毒性,数据表明9MW2821 具有可控的安全性。而Enfortumab vedotin的EV-301研究者≥3 级AE主要有皮疹(14%),疲劳(9%),上尿路感染(6%)等。
2)宫颈癌(CC):53 例可评估疗效的患者中,51% 受试者既往接受过含铂双药化疗及贝伐单抗治疗,58% 受试者既往接受过含铂双药化疗及免疫检查点抑制剂治疗,ORR 和DCR 分别为35.8% 和81.1%,mPFS 为3.9 个月,mOS尚未达到。Nectin-4 肿瘤细胞染色强度3+ 的患者中,39 例可评估疗效的患者ORR 为43.6%。分析:宫颈癌后线治疗中,9MW2821实现了3.9个月的mPFS,非头对头比较接近TF ADC的历史数据,表现出广谱的抗肿瘤潜力。(3)食管癌(EC):39 例可评估疗效的患者中,ORR 和DCR 分别为23.1% 和69.2%,mPFS 为3.9 个月,mOS为8.2 个月;其中37 例接受过铂类化疗及免疫治疗。分析:食管癌后线治疗中,9MW2821实现了3.9个月的mPFS以及8.2个月的mOS,非头对头比较同靶点辉瑞Enfortumab vedotin在内的其他药物表现优异,表现出广谱的抗肿瘤潜力以及同类产品中BIC的潜力。
(4)三阴性乳腺癌(TNBC):20 例可评估疗效的局部晚期或转移性三阴性乳腺癌患者中,ORR 和DCR 分别为50.0% 和80.0%,mPFS 为5.9 个月,mOS 尚未达到;其中,1 例完全缓解(CR) 患者已持续治疗20 个月,目前仍持续完全缓解。分析:TNBC后线治疗中,9MW2821实现了5.9个月的mPFS,非头对头比较优于同靶点辉瑞Enfortumab vedotin,表现出同类产品中BIC的潜力;此外mPFS数据与该领域数据最好的TROP2 ADC SKB264接近,表现出广谱的抗肿瘤潜力。
2.3.TF ADC:乐普生物MRG004A 胰腺癌后线治疗数据优异
本次ASCO 2024年会上乐普生物披露了其组织因子(TF)ADC药物MRG004A在实体瘤患者中的安全性和有效性的I/II期临床研究数据。临床数据:截至投稿日,63名患者已入组,其中43名患者处于剂量递增阶段(介于0.3至2.6mg/kg的8个剂量水平),20名患者处于剂量扩展阶段(15名患者为2.0mg/kg,5名患者为2.4mg/kg)。MRG004A在胰腺癌患者中观察到显著抗肿瘤活性。
在2.0mg/kg剂量组的12名既往已接受中位3线治疗的可评估PC患者中,有4例部分缓解(“PR”)及6例病情稳定(“SD”),客观缓解率(“ORR”)为33.3%(4/12),疾病控制率(“DCR”)为83.3%(10/12)。其中,5名患者为TF高表达(TF≥50%)且先前已接受2线或以下治疗的亚组中,4名患者达到PR,1名患者达到SD。TF高表达的ORR为80%(4/5),DCR为100%(5/5)。此外,MRG004A对三阴性乳腺癌(“TNBC”)及CC患者亦有疗效。在4名接受过多线治疗的TNBC患者中,ORR和DCR分别为25%(1/4)和50%(2/4)。
在2名接受过四线治疗的CC患者中,1名患者达到PR,1名患者达到SD。7.9%(5/63)的患者曾出现严重不良事件。剂量扩展阶段的评估仍在进行中。分析:胰腺癌后线治疗是当前临床未满足的治疗需求,该研究中MRG004A实现33.3%的ORR,在TF高表达(TF≥50%)患者中实现80%的ORR,提示TF ADC药物MRG004A有潜力成为胰腺癌治疗的选择。
2.4.EGFR ADC:乐普生物MRG003鼻咽癌后线治疗数据优异
本次ASCO 2024年会上乐普生物披露了其PD-1普特利单抗与表皮生长因子受体ADC(EGFR-ADC)MRG003联合治疗EGFR阳性实体瘤患者的安全性和有效性的I/II期研究的初步结果。临床数据:截至2024年1月30日,33名患者(I期:9名NPC、1名SCCHN及3名其他实体瘤患者,II期:14名NPC及6名SCCHN患者)已入组,中位年龄为52岁,其中25名患者为男性。在27名可评估患者中,17名患者达到PR,7名患者达到SD,ORR和DCR分别为63.0%(95%置信区间为42.4至80.6)及88.9%(95%置信区间为70.8至97.7)。在II期临床9名可评估的接受PD-1加铂类化疗的一线治疗后EGFR阳性NPC患者中,观察到2名患者达到完全缓解(“CR”),5名患者达到PR及2名患者达到SD,ORR及DCR分别为77.8%(95%置信区间为40.0至97.2)及100%(95%置信区间为66.4至100)。
5名可评估的未接受过系统治疗的EGFR阳性SCCHN患者中观察到3名患者达到PR及1名患者达到SD,ORR及DCR分别为60%(95%置信区间为14.7至94.7)及80%(95%置信区间为28.4至99.5)。
研究中的缓解持续时间(“DOR”)及无进展生存期(“PFS”)尚不成熟。接受治疗时间最长的患者的DOR超过17个月,且治疗仍在持续。4名患者发生3-4级常见治疗相关不良事件(“TRAE”),主要包括白细胞数量减少(9%)及低钾血症(6%)。接受HX008联合MRG003治疗的I/II期研究患者在NPC和SCCHN中表现出良好的耐受性和良好的抗肿瘤活性,尤其是经PD-1治疗失败的NPC患者。分析:MRG003在接受PD-1加铂类化疗的一线治疗后EGFR阳性NPC患者的二线治疗中联合PD-1单抗实现77.8%的ORR(CR为28.6%),数据优异,从现有数据看未来有望成为鼻咽癌二线治疗的治疗选择。

2.5.B7H3 ADC:翰森制药HS-20093小细胞肺癌数据优异
本次ASCO 2024年会上翰森制药披露了其B7H3 ADC HS-20093在小细胞肺癌的数据。临床数据:ARTEMIS-001研究包括剂量递增(1a)和扩展(1b)部分。患者在剂量递增阶段每3周接受1.0-16.0 mg/kg HS-20093给药,在剂量扩展阶段随机接受8.0 mg/kg和10.0 mg/kg给药。要求SCLC患者既往接受过铂类标准治疗。数据截止日期2023年11月30日,共有56例广泛期SCLC(ES-SCLC)患者入组并接受≥1剂HS-20093,剂量为8.0 mg/kg(n = 31)或10.0 mg/kg(n = 25)。
中位既往治疗线数为2.0(范围:1-6)。所有患者均接受了铂类药物加依托泊苷治疗,73.2%(41/56)接受了免疫治疗。安全性特征与既往报告一致。最常见的≥3级治疗相关不良事件(≧10%)为中性粒细胞减少症、白细胞减少症、淋巴细胞减少症、血小板减少症和贫血。在56例患者中,52例患者的疗效可评价(8.0 mg/kg:31例患者;10.0 mg/kg:21例患者)。
HS-20093在复发性ES-SCLC中显示出令人鼓舞的疗效(表)。96.2%(50/52)的基线后扫描患者的靶病灶出现肿瘤缩小。44.2%(23/52)的患者获得了深度缓解(定义为肿瘤缩小≥50%)。尚未达到中位总生存期。无论B7-H3表达如何,均观察到缓解。药代动力学(PK)显示暴露量大致与剂量成比例增加,半衰期为3-7天。总抗体和ADC的PK特征相似,有效负载暴露量相当低。分析:HS-20093 8 mg/kg Q3W剂量组在小细胞肺癌后线治疗中实现5.6个月的mPFS,未来在更高剂量组10 mg/kg Q3W下有望读出更优数据,有望成为小细胞肺癌治疗的选择。
2.6.FRαADC:百奥泰BAT8006卵巢癌数据优异
本次ASCO 2024年会上百奥泰披露了其FRαADC BAT8006在卵巢癌的数据。临床数据:截至2024年1月5日,100例中国晚期实体瘤受试者被分配到6个队列中,包括1.2、1.8、2.1、2.4 mg/kg和84、93 mg/m2剂量水平。52例铂类耐药的卵巢上皮癌、输卵管癌或原发性腹膜癌(OC)受试者入组并接受BAT8006 1.8 mg/kg(n = 2)、2.1 mg/kg(n = 16)、2.4 mg/kg(n = 15)、84 mg/m2(n = 10)或93 mg/m2(n = 9)剂量治疗。这52例受试者的中位随访持续时间为4.5(1.1,16.4)个月。在剂量递增研究中,2.4 mg/kg剂量队列报告了1起剂量限制性毒性,即4级血小板减少症。尚未达到最大耐受剂量。在52例OC受试者中,49/52例(94.2%)接受至少一剂BAT8006的受试者报告了至少一起治疗期间不良事件(TEAE)。最常见的任何级别TEAE(≥20%)为血小板减少症、中性粒细胞减少症、贫血、白细胞减少症、恶心、呕吐和便秘。
大部分TRAE为1级或2级;57.7%的受试者发生的3级或以上AE为最差级别,包括血小板减少症11/52(21.2%)、中性粒细胞减少症15/52(28.8%)、贫血11/52(21.2%)、白细胞减少症15/52(28.8%)。在84和93 mg/m2剂量队列(在剂量扩展研究中选择对其进行进一步探索)中,≥3级血小板减少症和中性粒细胞减少症的发生率分别为0%vs. 22.2%和30%vs. 33.3%。3例受试者(3/52,5.8%)在研究期间减量,11例受试者(11/52,21.2%)中断研究药物治疗。1例(1/52,1.9%)受试者因TEAE终止研究治疗。
研究期间报告了1例因肿瘤进展导致的死亡病例。在这52例受试者中,60.0%(31/52)既往接受过> 3线全身性治疗。其中36例至少有1次肿瘤评估。研究者评估的ORR(包括未证实的部分缓解[PR])为41.7%(15/36),与FRα表达无关。疾病控制率(DCR)为86.1%(31/36)。在25例FRαTPS≥50%的受试者中,ORR为11/25(44.0%),DCR为22/25(88.0%)。在12例FRαTPS≥75%的受试者中,ORR为6/12(50.0%),DCR为22/25(91.7%)。
3.双抗:多个新靶点新机制双抗首次披露数据,双抗领域国产创新品种崭露头角
3.1.PD-1/VEGF双抗:康方生物AK112 EGFR TKI耐药NSCLC数据披露
本次ASCO 2024年会上康方生物披露了其PD-1/VEGF双抗AK112治疗EGFR TKI耐药NSCLC 3期临床数据。临床数据:将患者按1:1的比例随机分配至接受Ivonescimab(AK112/SMT112) (20 mg/kg)联合培美曲塞(500 mg/m2)和卡铂(AUC 5)或安慰剂联合化疗,每3周一次,共4个周期,根据第三代EGFR-TKI(接受vs未接受)和脑转移(有vs无)进行分层,随后进行ivonescimab和培美曲塞或安慰剂和培美曲塞维持治疗。主要终点是意向治疗(ITT)人群的无进展生存期(PFS),由独立影像学审查委员会(IRRC)根据RECIST v1.1评估。在此报告了首次计划的期中分析的结果。共322例患者接受随机分组(161例分配至ivonescimab联合化疗组,161例分配至安慰剂联合化疗组)。
86.3%与85.1%的患者接受过第三代EGFR-TKI治疗,21.7%与23.0%的患者有脑转移。截至2023年3月10日,中位随访时间为7.89个月。Ivonescimab + 化疗组的PFS显著改善(HR 0.46[0.34,0.62],P < 0.0001)。IRRC评估的Ivonescimab组的中位PFS(95%CI)为7.06个月(5.85,8.74),化疗组为4.80个月(4.21,5.55)。预先规定的亚组分析显示,在几乎所有亚组中,PFS获益均有利于接受Ivonescimab的患者,包括第三代EGFR-TKI治疗期间进展的患者(HR 0.48,95%CI 0.35-0.66)、脑转移患者(HR 0.40,0.22-0.73)、EGFR突变19缺失的患者(HR 0.48,95%CI 0.35-0.66)、0.32-0.73)和T790M突变阳性个体(HR 0.22,0.09-0.54)。ORR分别为50.6%和35.4%。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)