2024医药生物报告:国产AR抑制剂及XDC药物市场展望
1.前列腺癌患者基数庞大CRPC治疗方案有限
1.1PSA辅助诊断的普及提升前列腺癌检出率新患
前列腺癌作为全球男性第二大常见癌症,2030年新发病例数预计高达181.5万例。前列腺癌源于前列腺内的健康细胞发生变化,生长失控后发展为肿瘤,可能致癌的风险因素包括BRCA1/BRCA2、HPC1/HPC2/HPCX以及CAPB等遗传变化。美国前列腺癌5年总生存率高达97.5%,中国仅69.2%。
局限期前列腺癌:前列腺癌的发病率和死亡率同年龄密切相关,大多数前列腺癌病例初诊时处于局限期,早期无症状且通常病程缓慢为惰性,晚期常表现为尿潴留和背痛。前列腺特异性抗原(PSA)作为前列腺组织表达的糖蛋白,通常可根据其检测的血浆水平(是否>4 ng/mL)来判断前列腺癌的可能。全球范围内PSA辅助诊断的普及也使得前列腺癌检出率保持上升趋势。根据弗若斯特沙利文预测,2030年美国新发病例将高达29.8万例,中国高达19.9万例。
转移性激素敏感性前列腺癌(mHSPC):伴随疾病进展及进行治疗,大约有45%的局限性前列腺癌患者将进展到mHSPC,该阶段对ADT治疗(雄激素剥夺疗法,包括药物去势和手术去势)仍然敏感。根据弗若斯特沙利文预测,2030年全球mHSPC新发病例数达242.9万例,其中美国35.0万例,中国42.4万例。
去势抵抗性前列腺癌(CRPC):即患者的血清睾酮已达到去势水平(<50ng/dL),包括局限性去势抵抗性前列腺癌(nmCRPC)和转移性去势抵抗性前列腺癌(mCRPC),CRPC患者中位生存期不足2年。1)绝大部分nmCRPC会进展为mCRPC;2)HSPC在平均接受ADT治疗后18-24个月会进展至CRPC。根据弗若斯特沙利文预测,2030年全球mCRPC新发病例数达208万例,其中美国36.2万例,中国17.5万例。
根据诺华在前列腺癌领域目标患者分布情况,针对mHSPC,全球范围内一线治疗人数占比当年新发人数高达90%,各个国家一线治疗人数占比基本保持在90%左右;针对mCRPC,全球范围内一线/二线治疗人数占比当年新发人数高达88%/62%,其中,中国/美国一线人数占比分别为89%/83%,二线人数占比分别为54%/60%。
1.2内分泌治疗&化疗占据主要市场,末线疗法欠缺
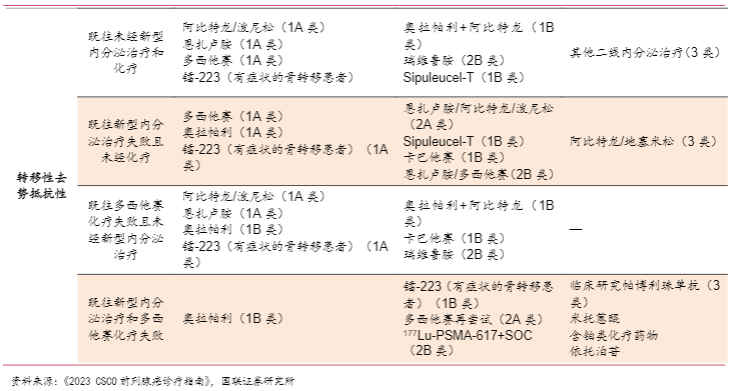
根据NCCN指南,M1 CSPC患者通常采用ADT疗法联用阿比特龙(CYP17A1抑制剂)/AR抑制剂(达罗他胺、恩扎鲁按、阿帕他胺)/多西他赛(化疗药物)作为标准疗法;具备高危转移风险的M0 CRPC患者则通常采用AR抑制剂作为标准疗法;M1 CRPC患者根据既往接受的新型内分泌治疗/化疗药物进行分层,可分别采用新型内分泌治疗、PARP抑制剂、多西他赛/卡巴他赛作为标准疗法,后续还可以采用米托蒽醌、K药、镭-223、Lu-177-PSMA-617等药物进行治疗。
根据CSCO指南,mHSPC患者通常采用ADT疗法联用阿比特龙(CYP17A1抑制剂)±泼尼松/AR抑制剂(达罗他胺、恩扎鲁按、阿帕他胺、比卡鲁胺)/多西他赛(化疗药物)/EBRT作为标准疗法;具备高危转移风险的nmCRPC患者则通常采用AR抑制剂作为标准疗法;M1 CRPC患者根据既往接受的新型内分泌治疗/化疗药物进行分层,可分别采用新型内分泌治疗、PARP抑制剂、多西他赛、镭-223作为标准疗法,后续还可以采用K药、Lu-177-PSMA-617等药物进行治疗。
2.广阔市场有望推动潜力大单品诞生
前列腺癌药物市场规模将保持快速增长。2024-2030年,全球前列腺癌药物市场规模预计从233亿美元增长至376亿美元,CAGR 8.3%;中国前列腺癌药物市场规模预计从155亿元增长至506亿元,CAGR 21.8%。
前列腺癌药物市场中,AR抑制剂、PARP抑制剂以及PSMA靶向放射性配体将作为市场规模扩张的主要支撑。根据Nature Review预计,2020-2029年前列腺癌药物市场规模将从112亿美元增长至301亿美元,其中AR抑制剂增量达111亿美元,PARP抑制剂增量47亿美元,PSMA靶向放射性配体增量高达11亿美元。
全球范围内前列腺癌研发管线高达1440项,主要集中于PSMA靶向疗法、AR抑制剂等。其中,CRPC研发管线高达709项,CSPC研发管线仅76项,神经内分泌前列腺癌研发管线达19项;CRPC聚焦于PSMA靶向疗法、AR抑制剂;CSPC聚焦于AR抑制剂、PARP抑制剂和CYP17A1抑制剂;神经内分泌前列腺癌聚焦于DLL3靶向疗法等。
2.1国产第二代AR抑制剂有望崛起
前列腺癌是雄激素依赖性癌种,调节激素水平作为其重要治疗方法。
针对去势敏感性前列腺癌,ADT治疗包括药物去势和手术去势,药物去势包括LHRH激动剂和拮抗剂。其中,如果患者存在承重骨转移,应在第一次应用LHRH激动剂前使用一代抗雄激素药物≥7d,或与LHRH激动剂同时使用,从而避免/降低睾酮“闪烁”效应,常用LHRH激动剂包括戈舍瑞林、亮丙瑞林、曲普瑞林;LHRH拮抗剂则能够快速降低睾酮,无睾酮“闪烁”效应,在骨转移患者中可显著降低肌肉骨骼事件发生,LHRH拮抗剂包括地加瑞克。
针对去势抵抗性前列腺癌,内分泌疗法包括雄激素生物合成抑制剂、雄激素受体抑制剂。其中,雄激素生物合成抑制剂主要以CYP17A1抑制剂阿比特龙为主,通过抑制雄激素制造过程中不可或缺的酶CYP17从而抑制雄性激素的产生,雄性激素受体抑制剂以AR抑制剂为主,通过抑制AR从而阻断细胞分子通路,包括氟他胺、比卡鲁胺、尼鲁米特、恩扎卢胺、阿帕他胺以及达罗他胺等。
AR抑制剂作为治疗前列腺癌的重要手段之一,全球市场规模保持快速增长。2024-2030年,全球前列腺癌AR抑制剂市场规模预计将从133亿美元增长至212亿美元,CAGR 8.1%;中国前列腺癌AR抑制剂市场规模预计将从72亿元增长至239亿元,CAGR 22.0%。
针对中美前列腺癌药物市场格局进行分析,中国LHRH药物占比超60%,美国AR抑制剂占比近60%。2021年美国前列腺药物市场规模达33.7亿美元,为全球最大市场,AR抑制剂恩杂鲁胺占比最大;而由于市场药物及用药差异等原因,2021年中国前列腺癌药物市场规模约13.4亿美元,AR抑制剂占比仅11%,中国作为前列腺癌高增速潜力市场,伴随AR抑制剂加速放量,未来产品将有较大增量空间。
目前中美获批的AR抑制剂共7款,其中第一代AR抑制剂共3款,第二代AR抑制剂共4款。1989-1995年,FDA分别批准第一代AR抑制剂氟他胺、尼鲁米特以及比卡鲁胺首次上市,但因第一代AR抑制剂同AR结合能力较弱、治疗效果较差、治疗过程中诱发AR突变等原因逐渐被欧美淘汰;2012年,第二代AR抑制剂恩扎卢胺获FDA批准上市,其与AR结合能力强,能够克服第一代AR抑制剂突变导致的耐药性而逐渐得到广泛使用,2018年以来,阿帕他胺、达罗他胺以及瑞维鲁胺陆续获批上市。
中国市场第二代AR抑制剂存在较大成长空间。AR抑制剂恩扎卢胺在2012年经FDA获批用于治疗化疗失败后的mCRPC,目前已获批的适应症还包括未经化疗的mCRPC、nmCRPC和mHSPC,恩扎卢胺于2019年被NMPA批准用于治疗mCRPC,2020 年进入国家医保乙类目录。2022年恩扎卢胺(安斯泰来)全球销售额高达54.3亿美元,根据PDB数据库,2023年恩扎卢胺(安斯泰来)中国全渠道销售额仅3.1亿元。
根据CHART临床试验,瑞维鲁胺片联合ADT疗法vs比卡鲁胺联合ADT疗法中,主要研究终点放射影像学无进展生存期(rPFS)、总生存期(OS)的期中分析结果达到方案预设的优效标准。瑞维鲁胺片是第二代AR抑制剂,相较于第一代AR抑制剂,具有更强的AR抑制作用,且无激动作用;相较于最早上市的二代AR抑制剂恩扎鲁胺,瑞维鲁胺中枢神经安全性更优。自2022年获NMPA批准上市,同年纳入国家医保乙类目录。
2.2PARP抑制剂适应症拓展带来销售增量
目前全球共7款PARP抑制剂获批,2020年FDA分别批准奥拉帕利和鲁卡帕尼用于治疗AR抑制剂进展后的mCRPC。其中奥拉帕利单药批准用于患有有害或疑似有害种系或体细胞同源重组修复(HRR)基因突变的患者(20-30%病例),鲁卡帕尼则被批准用于此前接受过化疗并患有有害BRCA突变的患者(约12%病例);2023年,他拉唑帕利、尼拉帕利+醋酸阿比特龙在前列腺癌领域相继获批。
PARP抑制剂针对前列腺癌有效性和安全性良好。针对HRR+患者,尼拉帕利+阿比特龙+泼尼松vs 安慰剂组:mrPFS(16.5m vs 13.7m),ORR(59.7% vs 28.1%);针对BRCA1/2/ATM突变患者,奥拉帕利vs 恩扎鲁按/阿比特龙:mrPFS(7.4m vs 3.6m),mOS(18.5m vs 15.1m)
2.3Pluvicto有望成超百亿美元销售大单品
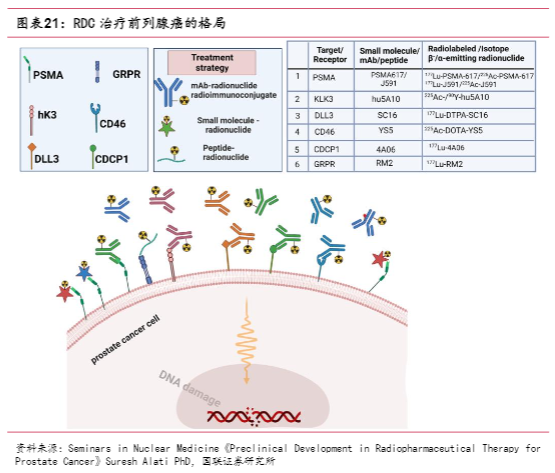
治疗性放射性药物由治疗性放射性核素和高亲和力、靶向肿瘤的载体分子组成。单克隆抗体、抗体衍生片段、肽和小分子经常被用作肿瘤靶向分子,主要靶向PSMA、KLK3、DLL3、CD46、CDCP1以及GRPR等;Lu-177则作为使用最广泛的放射性核素,此外可发射α粒子的Ac-225也在评估研究中。
2022年3月,FDA批准靶向PSMA的Pluvicto(177Lu-PSMA-617)用于治疗mCRPC,同年12月该产品于欧洲获批。采用同种技术路径的177Lu-PSMA放射性疗法中,Curium、远大医药和礼来的产品临床进度靠前;此外,全球范围内针对223Ra、13C以及131I等不同放射性核素均有布局,主要靶点为PSMA。
诺华Pluvicto自上市以来销售放量迅速,2022年销售额达2.71亿美元,2023年销售额高达9.8亿美元。2024年及以后,诺华预计RLT年产能目标达到25万支,若单支定价为4.79万美元,Pluvicto规划年产值将达到120亿美元,终端产品放量或将赋能RDC诊断治疗全产业链。
2.4ADC疗法为患者提供更多用药选择
前列腺癌领域的ADC疗法主要针对B7-H3、Nectin-4、Trop-2以及PSMA等靶点进行开发。其中B7-H3 ADC中,MacroGenics研发进度最快,mCRPC处于II/III期临床阶段;Nectin-4 ADC中,EV处于临床II期阶段;Trop-2 ADC中,Trodelvy、SKB-264、DS-1062针对mCRPC均已进入临床II期阶段。此外,具备成药潜力的靶点还包括PSMA、STEAP1、Tissue Factor等。
ADC为耐药的转移性去势抵抗性前列腺癌末线患者提供更多用药选择。EV vs DS7300:mPFS(5.5m vs 4.8m),ORR(75% vs 25%),戈沙妥珠单抗6个月rPFS率为45%,PSMA ADCPSA50达14%。
考虑到ADC的作用机制与RDC存在互补,我们相信未来ADC+RDC的疗法也可以和ADC+PD-(L)1类似,通过联合用药冲击前列腺癌的前线疗法市场,为患者提供更多和更优的治疗选择。
3.产业链具备前列腺癌大单品赋能逻辑的相关药企
3.1恒瑞医药
创新药管线临床价值凸显,驱动收入增长。截至2023H1,公司目前已有13款自研创新药、2款合作引进创新药在国内获批上市。其中,瑞维鲁胺是中国首个自主研发的AR抑制剂,2022年6月获批高瘤负荷的转移性激素敏感性前列腺癌适应症,同年纳入医保目录,未来有望持续爬坡贡献业绩增量。
3.2海创药业
公司以PROTAC靶向蛋白降解和氘代技术等平台为基础,专注于癌症、代谢性疾病等具有重大市场潜力的治疗领域的创新药物研发。核心产品HC-1119提交了新药上市申请,较恩杂鲁胺具备有效性好、安全性好、病人依从性更好以及专利有效期更长等优势。HP518公司是自主研发的新一代AR降解剂,能同时降解野生型AR和点突变型AR,目前研究数据表明其具有以下优势:稳定性好;具有良好的口服生物利用度;降解AR活性高,DC50达到pmol级;肿瘤组织暴露量高,成药性强。
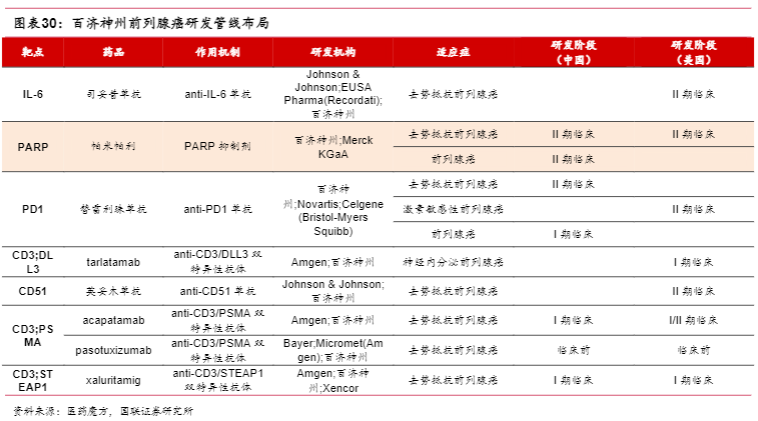
3.3百济神州
百济神州作为全球性的生物技术公司,同多家实力药企合作开发前列腺癌管线,产品布局丰富。其中已上市产品百泽安(替雷利珠单抗)和百汇泽(帕米帕利)均在前列腺癌领域拓展适应症,目前全球范围内已有多款PARP抑制剂在前列腺癌领域获批,百汇泽在前列腺癌领域已进入II期临床阶段。
公司近年来重点打造从诊断用核药到治疗用核药的全产业链体系,全面布局诊疗一体化和精准医疗。氟[18F]思睿肽作为靶向PSMA的放射性体内诊断药物,同PSMA蛋白具有较高的特异性亲和力,可在PSMA高表达的肿瘤中高度浓聚,从而可以将氟[18F]带至前列腺癌患者PSMA表达阳性部位,可适用于前列腺癌患者PSMA阳性病灶的PET,氟[18F]思睿肽在前列腺癌领域已进入III期临床阶段。
本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。