2024医药生物行业报告:创新药政策回暖与CRO投资机会
1. 板块观点
1.1. 医药估值极具有吸引力,重点推荐中药OTC及创新药
本周、年初至今生物医药指数涨幅分别为-2.33%、-12.08%,相对沪指的超额收益分别为-2.12%、-15.18%;本周医药商业、生物制品及中药等股价跌幅较小,医疗服务、器械及化药等股价跌幅较大;本周涨幅居前首药控股(+12.95%)、博晖创新(+11.16%)、泰格医药(+10.91%),跌幅居前大理药业(-22.55%)、贝瑞基因(-18.18%)、海创药业(-16.02%)。涨跌表现特点:本周医药板块普跌,临床CRO相对较强。
2024年创新药很可能出现大机会,不亚于2015-2017年行情,后者主要集中药审中心优化相关政策。近日国家发改委主导的全链条支持创新药征求意见稿,缩短临床批件时间、突破进院难、DRG/DIP等豁免等,药审中心、卫健委、医保局等积极配合,如果正式文件改动不大将会对创新药产生实质性积极影响。重点关注新诺威、海思科、恒瑞医药、百济神州、迪哲药业、迈威生物等。另外随着国内创新药产业政策积极回暖,国内临床CRO、仿制药CRO等回暖现象明显,重点关注泰格医药、诺思格、百诚医药、阳光诺和等。
历史大底部,多因素支撑医药板块企稳回升?主要原因;其一医药政策积极转变。国内创新药产业地位上升、国常会针对医药工业、医疗装备2023-2025的高质量发展等;其二在生命科学领域国际化进程加快。国内创新药海外授权屡创新高、FDA获批产品数量稳步增加;其三医药板块极刚性需求。未来10年每年加入60岁的2400万人支付能力强;其四医药板块连续下跌4年,截至2024年3月29日PE约20倍、估值切换后大批公司估值PEG显著小于1,其中最贵的医疗服务2024年3月29日估值约30余倍,大部分个股估值约15-20倍。【投资策略】具体配置思路:
临床及仿制药CRO:诺思格、泰格医药、百诚医药、阳光诺和等;创新药领域:
创新药领域:百济神州、恒瑞医药、海思科、迈威生物,赛生药业、和黄医药、康诺亚,建议关注泽璟制药-U、迪哲药业;
2. 国内医药研发需求逐步企稳,关注订单边际改善下的国内CRO投资机会
2.1 中国CRO市场增速可观
全球CRO市场稳步扩容,到2025年将超过千亿美元规模。随着医药研发支出增加,医药研发外包需求增长,全球CRO市场规模持续扩容。根据弗若斯特沙利文预测,2022年全球CRO市场规模预计约为776亿美元,2025年预计约为1027亿美元,2018-2022年CAGR为9.53%;2022-2030E年CAGR预计为9.33%。其中细分临床CRO市场占比最大,2022年约占CRO市场的70%,市场规模约为547亿美元,2030年也有望增长至超过千亿美元,2018-2022年CAGR为9.56%;2022-2030E年CAGR为8.10%。
中国CRO市场增速高于全球,其中临床CRO市场扩容明显。根据弗若斯特沙利文预测,2022年中国CRO市场规模预计约为814亿元,2030年预计增长至2758亿元,2018-2022年CAGR为22.20%;2022-2030E年CAGR为16.48%。2022年细分临床CRO市场约占CRO市场的51%,市场规模约为411亿元,2030年预计增长至1365亿元,2018-2022年CAGR为18.22%;2022-2030E年CAGR为16.18%。
2.2 制药行业逐步转型,扩大医疗研发外包服务需求
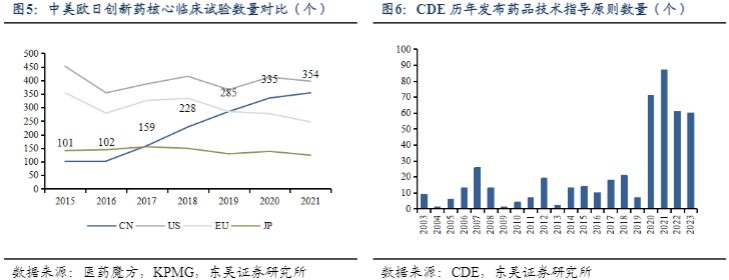
中国制药行业逐步由生产销售仿制药向创新药转型,研发难度加大,扩大CRO需求。过去中国一直以仿制药为主,现阶段正处于由低端仿制药向创新药转型阶段。与发达国家相比,中国的创新药研发仍处于落后阶段。但基于中国庞大的患者基数、庞大的科研投入、利好创新药的政策,中国创新药发展迅速,增速远远高于世界平均增速。2016年实行《关于解决药品注册申请积压实行优先审评审批的意见》,重点支持新药等药物的优先审批。次年中国上市新药数量突增,达45个。2020年新修订的《药品注册管理办法》加快新药上市审批速度,助力中国创新药项目井喷式增长。根据医药魔方数据,2021年中国NDA和获批上市新药数量出现小高峰,分别为86个和76个;2022年受新冠和投融资双重影响,有所回落,但在2023年看到了强劲的反弹,NDA和获批上市新药数量分别达到126个和79个。
药政部门对创新药发展提出更高要求,更高研发风险下临床CRO作用将日益凸显。2015年以来新药审评审批制度改革带动了国内创新药行业整体发展,实现了从“小”到“大”的过程,也见证了国内新药研发的活力。然而,中国创新药在新药的原始创新上仍存在不足,还是以快速模仿、改造为主,这直接导致了研发阶段的同质化竞争加剧和新药商业化阶段销售空间被压缩,并不利于行业的可持续发展。随着中国药品审评制度不断完善,药监机构对药品注册上市监管趋严,对临床试验数据质量要求更高的情况下,为缩短药品研发及上市的周期,更加兼具效率和成本的研发外包模式有望成为更多药企的选择,临床CRO外包率有望提升,带动整体医药研发外包需求。
2.3 生物医药投融资回暖,医药CRO市场将进一步重回快速增长通道
2023年IND、新药临床试验等数据均有所增长,研发需求显著恢复。随着政策面的鼓励和国内biotech企业的涌现,中国IND数量在2021年前经历了快速的增长,其中2021年创新药IND受理数量达到2366件,同比增长45.7%。而受生物医药投融资额下降、《以临床价值为导向的抗肿瘤药物临床研发指导原则》和2022年新冠疫情频发影响,创新药行业受到明显影响,根据我们统计,2022年创新药IND受理数量约为2203件,同比略降6.9%。而自2022年末疫情放开以来,新药临床试验推进更加畅通,创新药IND申请观察到了明显的复苏迹象,创新药管线作为各家药企的核心资产,新药项目推动仍是首要任务,2023年创新药IND受理数量达到2972件,同比增长34.9%。同时,2017年至2023年,新药临床试验数量呈增长趋势,特别是2023年新药临床试验也有恢复性增长,研发需求有所改善。
仿制药研发需求强劲,其中仿制药验证性临床试验数量激增带来新需求。随着药品集中采购和一致性评价工作的开展,仿制药研发需求强劲,带动了仿制药CRO行业的发展,涌现了以阳光诺和和百诚医药为代表的仿制药CRO企业。而在人口老龄化的压力下,未来仿制药的需求仍有很大的提升空间,因此可以看到ANDA申请接续了一致性评价的增长。2023年需技术审评的ANDA达3852件,同比增长66.2%。值得注意的是,随着更多的注射液等复杂制剂品种出现,验证性临床的申请也呈现了非常快速的增长,成为仿制药研发中的新需求。
生物医药投融资正慢慢回暖,药物研发需求将有望得到充分释放。从药物临床试验数、IND/NDA申请数量等可以看出国内研发的需求表现是较为不错的,但受到生物医药投融资不景气的影响,行业需求释放的速度、订单的价格等表现较为一般。从IND数量同比高速增长而临床一期试验数量未见相匹配的增长,我们认为存在一定的管线数量未在2023年充分释放,而其中生物医药投融资的低迷导致了Biotech资金的困难从而造成了管线数量的推进。从近几个月的投融资数据来看,全球、国内的情况均有环比改善,而随着今年内美联储较大概率推动降息工作,投融资将有望进一步改善,Biotech面临的资金问题将有所缓解,从而驱动药物研发需求的释放。
3. 研发进展与企业动态
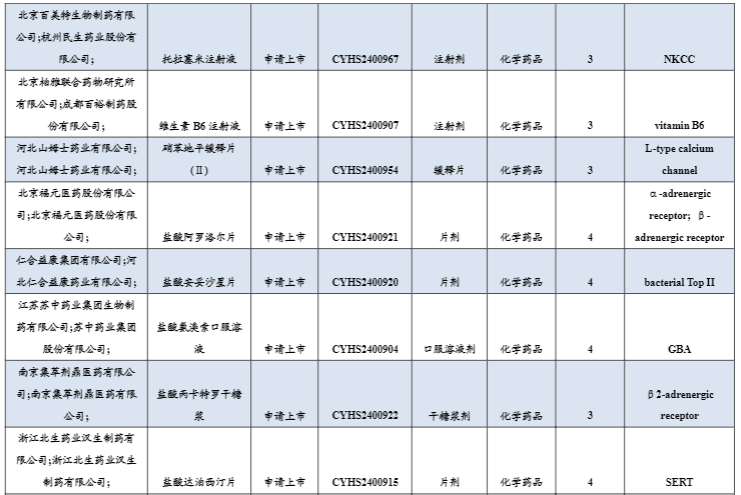
3.1 创新药/改良药研发进展(获批上市/申报上市/获批临床)
3月24日,远大医药宣布其用于治疗胃肠胰腺神经内分泌瘤的全球创新放射性核素偶联药物(RDC) ITM-11已获得国家药监局批准开展III期临床研究(COMPOSE研究,NCT04919226)。
3月25日,石药集团发布公告,宣布其开发的司美格鲁肽注射液已获国家药品监督管理局批准,可在中国开展用于减少热量饮食和增加体力活动的基础上对成人超重或肥胖患者的体重管理适应症的临床试验,也是该产品继成人2型糖尿病患者的血糖控制后,获批临床试验的第二个适应症。
3月25日,阿斯利康宣布FDA已经批准Ultomiris(ravulizumab-cwvz)新适应症上市,用于治疗抗水通道蛋白4(AQP4)抗体阳性(Ab+)视神经脊髓炎(NMOSD)。
3月26日,默沙东宣布Sotatercept治疗肺动脉高压(PAH)的上市申请获得FDA批准,商品名为Winrevair。本次获批上市是基于III期STELLAR研究的积极结果。该研究共纳入323例正在接受稳定的背景疗法治疗的成人PAH患者,旨在评估Sotatercept对比安慰剂作为附加疗法的有效性和安全性。
3月27日,和黄医药赛沃替尼片新适应症上市申请获CDE受理。根据和黄医药近期发布的年度报告,推测此次申报适应症为:一线及二线治疗MET外显子14跳跃突变非小细胞肺癌(NSCLC)患者,有望将赛沃替尼片在中国的适应症拓展到一线患者。
3月27日,CDE官网显示,Santhera制药和曙方医药的Vamorolone口服混悬液新药上市申请获受理,用于治疗四岁及以上杜氏肌营养不良(DMD)患者。
3月27日,Akebia Therapeutics宣布FDA已经批准vadadustat上市(商品名为:Vafseo),用于治疗至少接受3个月透析的慢性肾病(CKD)贫血患者。Vafseo是一款小分子缺氧诱导因子-1脯氨酰羟化酶(HIF-PH)抑制剂,通过增加内源性促红细胞生成素的产生,改善铁的吸收和动员以及下调铁调素来促进红细胞生成。
3月27日,CDE网站显示,强生的古塞奇尤单抗注射液新适应症上市申请获得药监局受理,推测用于治疗中重度活动性克罗恩病(CD)成年患者,此外该适应症已被纳入优先审批。
3月27日,药物临床试验登记与信息公示平台显示,康乐卫士生物和成大生物登记了一项重组十五价人乳头瘤病毒疫苗(大肠埃希菌)I期临床试验。
本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。