2024医药行业报告:艾迪药业HIV药物市场增长与创新药前景分析
1、率先布局抗HIV新药,首个国产HIV三联复方单片获批
江苏艾迪药业股份有限公司于2009年12月15日成立,是一家专注于医药领域,集药品研发、生产、销售于一体的创新药企。依托稳健的人源蛋白业务,2020 年公司营收2.89 亿元,归母净利润3977 万元。抗HIV创新药艾诺韦林和艾诺米替上市后,公司加大了费用投入,导致亏损。2023年业绩快报显示,公司HIV新药销售初步起量,同比亏损大幅收窄。目前,公司从自身核心优势出发,围绕抗HIV为主的抗病毒领域及人源蛋白领域,着力打造抗艾滋病、抗炎和脑卒中等领域的研发管线,以国内临床需求为导向,加速推进创新药研发。
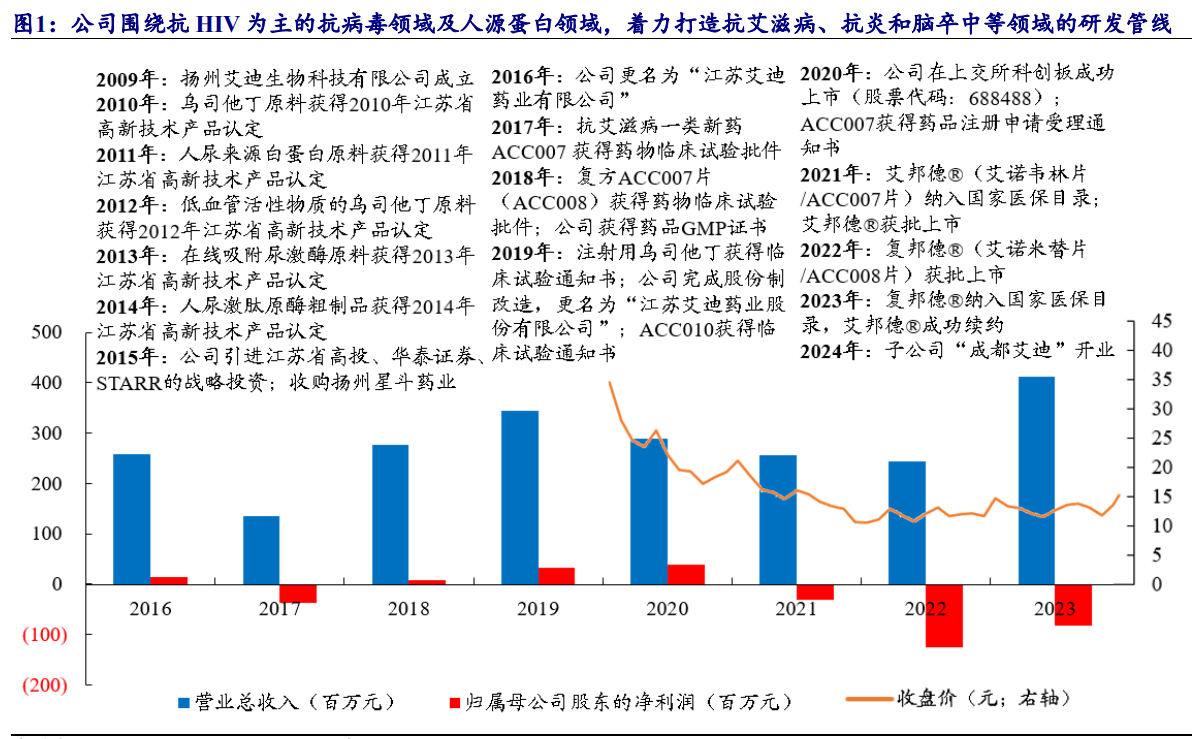
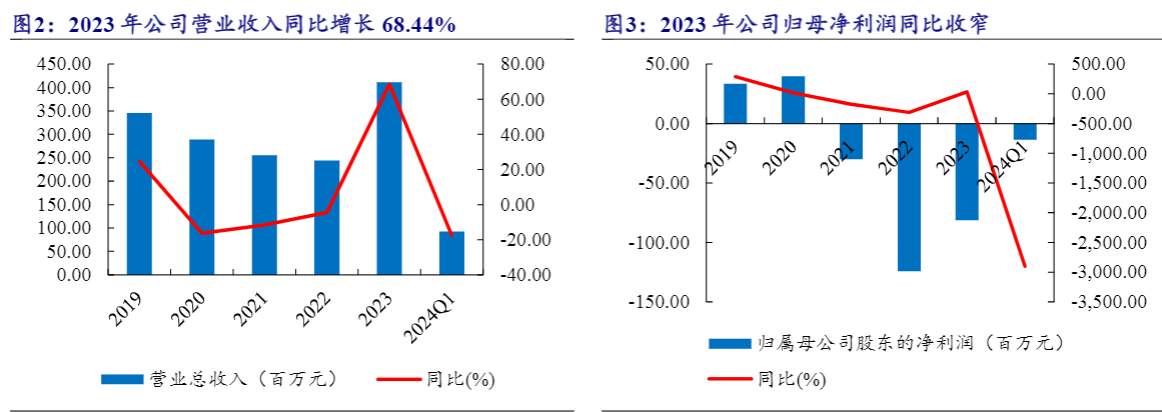
公司业绩增长较快,HIV新药快速放量。2023年,公司实现营业收入4.11亿元,同比增加68.44%,主要由于HIV创新药销售、尿激酶及普药销售收入实现较快增长;2024Q1公司实现营业收入0.93亿元,同比下滑17.52%,主要系公司人源蛋白粗品业务收入同比减少3821.41万元、HIV新药业务收入同比增加1548.09万元所致。公司2023年实现归母净利润为-0.76亿元,归母净利润同比减少亏损38.70%,主要系2023年公司主营业务毛利较2022年增加0.85亿元;2024Q1公司实现归母净利润-1361万,同比下滑2898.79%,主要系公司继续专注新产品开发,加大研发投入,研发费同比增加792.01万元所致。
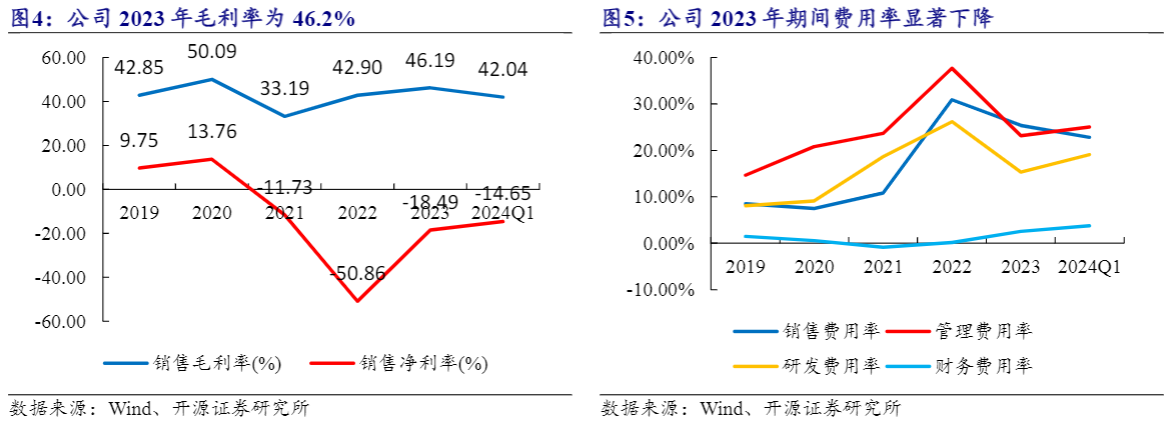
公司毛利率水平较高,2023年期间费用率显著下降。2023年公司毛利率有所提升,为46.19%,同比增加3.29pct,净利率为-18.49%,同比增加32.37pct。公司2023年期间费用率显著下降,为51.09%,同比下降17.69pct。公司现阶段将HIV新药商业化作为重点任务之一。在人才梯队方面不断优化补充各区域营销队伍;在项目管理方面密切关注重点医院准入工作情况并动态调整相关策略;在业务模式方面不断提升药物的可及范围,现阶段适当下沉基层;在树立公司及产品品牌形象方面,做好患者教育工作,提升患者对公司产品的认知度、接受度与依从度;在学术推广方面,强化市场部学术推广职能,与中艾协合作利用中华医学会艾滋病、丙肝全国年会卫星会、复邦德®三期临床数据全国巡回演讲等高端学术会议,以循证数据为基础宣传公司品牌以及产品优势。
公司股权结构清晰,子公司分工明确。截至2023年年报,公司实际控制人是傅和亮,通过广州维美对艾迪药业持股比例为22.46%。公司股东傅和祥为傅和亮之弟,直接持有发行人3.13%股份。公司下设安赛莱医药科技有限公司、扬州艾迪制药有限公司、扬州诺康大药房有限公司、南京艾迪医药科技有限公司、成都艾迪医药技术有限公司等多家子公司,各个子公司分工协作,业务明确。
1.1、HIV新药纳入医保,公司在研创新药管线丰富
公司抗HIV领域两款创新药均进入国家医保目录。2023年12月,艾诺米替片(复邦德)已顺利通过医保谈判,成功被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》;新一代非核苷类逆转酶抑制剂艾诺韦林片(艾邦德)成功续约。结合医保报销的支付端优势,2024年公司将持续加大医院覆盖数量,针对医院规模、影响力及学术地位及HIV患者人数进行分级管理,促使药品快速放量。
多款早期潜力新药持续推进,公司创新管线布局丰富。艾迪药业瞄准病毒、炎症及脑卒中等重大疾病方向,综合采用许可引进、自主研发等方式打造研发管线。截至2023年12月31日,公司在研项目18 项,核心包括8 个1 类新药和4 个2 类新药;公司两款抗艾滋病1 类创新药艾诺韦林片、艾诺米替片已获批上市并进入商业化阶段。截止至2023年12月31日,公司累计提交专利申请82项,累计获得授权专利30 项,其中发明专利15 项。
2、HIV总感染人数不断提升,抗HIV药物市场持续扩容
HIV病毒主攻人体免疫系统,作用机理明确。艾滋病,即获得性免疫缺陷综合征(AIDS),其病原体为人类免疫缺陷病毒(HIV),亦称艾滋病病毒。HIV以人体免疫系统中最重要的CD4T淋巴细胞作为主要攻击目标,大量破坏该细胞,使人体丧失免疫功能,致使人体易于感染各种疾病,并发生恶性肿瘤,病死率较高。HIV感染人体后,选择性地吸附于靶细胞的CD4受体上,在辅助受体的帮助下进入宿主细胞。细胞质中的病毒RNA在酶作用下,形成双链线性DNA进入细胞核内,在整合酶的作用下整合至宿主细胞的染色体DNA中。在细胞RNA聚合酶的催化下,病毒DNA转录形成RNA,产生子代病毒的蛋白质和酶类。病毒蛋白与子代基因组RNA再进一步组合,最后形成具有传染性的成熟病毒颗粒。
2.1、HIV总感染人数持续上升,用药需求不断增长
新增感染者人数下降,总感染者人数仍在上升。根据联合国艾滋病联合规划署(UNAIDS)的预测,截至2022年,全球约有3900万艾滋病患者。虽然新增艾滋病患者数量正在逐年下降,但2022年全球新增患者数仍预计在100-170万。中国范围内,截至2022年底,我国报告存活艾滋病感染者122.3万,其中,2022年报告新增发病人数52058人。
存活HIV感染者规模不断扩大,抗HIV药物市场仍在扩容。据UNAIDS估测,全球艾滋病感染者发现率达到86%,能获得抗反转录病毒治疗(ART,即鸡尾酒疗法)的确诊者达到89%,体内病毒得到抑制的受疗者达到93%。中国正大力推进抗艾滋病进程,对于重点地区实施专项行动方案,其中凉山地区感染者发现率由81.70%提升到90.52%,治疗覆盖率从41.10%提升到94.81%,治疗成功率从57.50%提升到94.80%。随着政策的大力推进以及发现率和治疗覆盖率的持续上升,国内存活艾滋病患者规模扩大,抗HIV药物的市场规模也在连年扩增。
2.2、医保目录中抗HIV药品不断扩增,抗HIV药物持续发展
抗HIV药物共六大类,数十种药物已上市。为延长感染者预期寿命、提高感染者生活水平,抗病毒治疗药物和方案不断发展。目前抗反转录病毒共有6大类,分别为核苷类逆转录酶抑制剂、非核苷类逆转录酶抑制剂、蛋白酶抑制剂、整合酶抑制剂、CCR5拮抗剂、融合抑制剂。不同种类的抗HIV药物作用于逆转录过程的不同靶点,实现最大限度地抑制病毒复制,减少病毒变异、重建免疫功能。
采用两种核苷类逆转录酶抑制剂(NRTIs)和一种第三类药物共同使用。第三类药物包含非核苷类逆转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶抑制剂(INSTIs)、CCR5拮抗剂、融合抑制剂(FIs)。在2019年WHO推荐的成人首选一线疗法中,采用ISTIs多替拉韦(DTG)作为第三类药物;备选一线疗法中则采用NNRTIs药物依非韦伦(EFV)作为第三类药物。
免费药物目录更新较慢,药品副作用较大。为减轻感染者及其家属负担,国家自2004年开始正式施行艾滋病“四免一关怀”政策,为艾滋病感染者提供部分免费药物,并编录《国家免费艾滋病抗病毒药物治疗手册》,供者及其家属参考。但目前入选免费目录中的药物存在一定问题。例如五版免费目录均采用的齐多夫定,目前被发现会产生骨髓抑制、胃肠道反应、乳酸酸中毒等副作用。
医保目录中艾滋病药品持续扩容,为感染者带来更多选择。免费药物目录更新较慢,其中部分药物存在疗效、耐药性及不良反应方面的缺陷。为改善情况,国家一方面对《国家免费艾滋病抗病毒药物治疗手册》进行持续修订,根据药物表现进行增减,另一方面,国家医保目录正在不断增加艾滋病相关药物。
医保+自费的抗HIV药物市场规模逐年扩大。面对免费目录中的药物存在的诸多问题,近年医生和患者选用医保目录及自费药品的比例逐年增加。2020年以来,我国医保+自费抗HIV药物的消费金额以较高的增速增长,根据中商情报网,2022年中国医保+自费抗HIV药物预计约为2.4亿美元,而免费抗HIV药物的消费增速放缓,越来越多的消费者倾向选用疗效更好、不良反应较轻的抗HIV药物,为医保+自费抗HIV药物赛道提供了广阔前景。
国内4款艾滋病竞品药物进入医保。根据2023年国家医保目录显示,目前国内有4款艾滋病药物进入医保,分别为Gilead的捷扶康和必妥维,GSK的多伟托以及MSD的德思卓。其中,除了德思卓属于非核苷类复方单片外,其余都属于常见整合酶抑制剂。价格方面,捷夫康、必妥维、多伟托以及德思卓的价格分别为43元/片、31.13元/片、29.50元/片以及29.60元/片,均高于公司产品艾诺韦林片(8.58元/片)以及艾诺米替片(24.15元/片)。因此,凭借公司HIV新药较低的价格优势,加之公司对HIV新药的大力推广,产品销量有望进一步提升。
国内抗HIV创新药物较为稀缺。目前国内仍以抗HIV仿制药市场为主,但传统抗HIV药物存在较大的副作用;另一方面,疗效与安全性更佳的进口高端药物价格高昂。国内感染者的用药诉求未能满足,创新药市场具有较大空间。目前,已经上市的国产创新药物仅有4款:为前沿生物的艾博卫泰(于2018年获批)、艾迪药业的艾诺韦林和艾诺米替片、真实生物的阿兹夫定(于2021年7月获批、有条件上市)。
其中,艾博卫泰是融合抑制剂,用于治疗已经接受过其他多种抗逆转录病毒药物治疗但仍有HIV病毒复制的患者,其为冻干粉针剂型,静脉滴注给药,每周一次,同时需要每日口服洛匹那韦利托那韦(克力芝),达到协同用药之目的;艾诺韦林片和艾诺米替片在适应症领域、给药途径以及患者群体方面与艾博卫泰存在明显不同;阿兹夫定是核苷类逆转录酶和辅助蛋白Vif抑制剂,用于与核苷逆转录酶抑制剂及非核苷逆转录酶抑制剂联用,治疗高病毒载量的成年HIV-1(艾滋病)感染患者。
3、首个国产三合一复方制剂艾诺米替片有望进一步放量
NNRTIs是一线疗法推荐的重点药物类别之一,目前已更新至第三代。第一代NNRTIs药物主要有奈韦拉平、依非韦仑,其特点是有效性良好,但有较为显著的不良反应,导致患者依从性较差,甚至因其精神毒性导致患者出现自杀倾向;第二类NNRTIs药物以依曲韦林、利匹韦林为代表,此代NNRTIs药物特点是药物毒性降低,但对高病毒载量病人的有效性下降。第三代NNRTIs药物在第一代NNRTIs的基础上改善了安全性,目前新药在持续研究如何将药物的半衰期和药物间相互作用纳入结构设计,以期在各方面提高药物的疗效。
3.1、艾诺韦林片:第三代非核苷类逆转录酶抑制剂,已纳入医保和推荐指南
艾诺韦林片:抗HIV治疗新药,成功纳入医保和推荐指南。艾诺韦林片为公司研发的抗HIV治疗的第三代非核苷类逆转录酶抑制剂(NNRTIs),于2021年6月25日在国内获批上市,当年即被《中国艾滋病诊疗指南(2021版)》推荐,并成功纳入国家医保目录。艾诺韦林3期临床试验数据ACC007-301研究于2023年4月登上《The Lancet》期刊。本研究是一项为期48周的多中心、随机、双盲双模拟、阳性平行对照、非劣性3期临床试验,对比艾诺韦林+3TC+TDF与EFV+3TC+TDF的联合用药方案的疗效和安全性,每日一次,双盲状态下治疗48周,揭盲后按受试者意愿选择治疗方案延长开放治疗至96周。
艾诺韦林方案相较EFV方案在病毒学抑制方面显示出非劣效性。病毒学抑制方面,结果显示艾诺韦林组抗病毒疗效与EFV组相当,初始治疗48周可获得良好的病毒学抑制,扩展至96周病毒学抑制持续有效。在第48周,ANV组315名受试者中有274人(87.0%)和EFV组314名受试者中的288人(91.7%)达到HIV-1 RNA<50拷贝/mL,艾诺韦林方案相较EFV方案显示出非劣效性(差异:-4.7%,95%,置信区间:-9.6%至0.1%)。治疗96周艾诺韦林持续治疗组和EFV经治转换为艾诺韦林组病毒持续抑制率均达到90%以上(组间无差异,p=0.189)。Log10 HIV-1 RNA 与基线相比的平均变化:第48周,艾诺韦林组变化为-2.90(95%可信区间:-2.91至-2.75),EFV组为-2.80(-2.89至-2.74)。
艾诺韦林组较EFV组免疫重建效果优。免疫重建方面,结果显示初始治疗48周后,艾诺韦林组较EFV组可获得更好的免疫重建;扩展至96周,艾诺韦林持续治疗组免疫重建优于EFV转换为艾诺韦林组。治疗48周艾诺韦林组CD4+T细胞计数的平均值增加高于对照组EFV组;治疗96周艾诺韦林持续治疗组CD4+T细胞计数的平均值增加同样也高于EFV转换为艾诺韦林组。
艾诺韦林组较EFV组总体安全性较好。初始治疗48周ANV组315名受试者NNRTI治疗相关不良事件(TEAEs)的发生率为67.6%,显著低于EFV组314名受试者的91.4%(p<0.001)。EFV转换为艾诺韦林再治疗48周,不良事件发生率降低(91.4%降至64.1%)。在EFV组中,头晕、血脂异常、转氨酶升高、γ-谷氨酰转移酶升高、异常做梦、皮疹以及神经系统疾病等的发生率更高。
初始治疗48周,艾诺韦林组血脂异常发生率显著低于EFV组。单看血脂状况,在治疗的前48周,与EFV组相比,ANV组的高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白蛋白胆固醇(LDL-C)、TG和TC血清浓度显著降低,低于EFV组(均p<0.05),其中对LDL-C、TG、TC更具有优效性;EFV转换为艾诺韦林再治疗48周,血脂异常发生率降低,TG、TC改善。
公司2023年艾诺韦林片销售额达到2474万元。据公司公告,公司艾诺韦林片自2021年Q4正式开始推广销售,单季度销售137万元。随着公司不断加大销售推广力度,2022年公司产品销售额为3350万元,2023年销售2474万元,当年对应销售量为59386瓶。我们预计该产品的销售额会借助艾滋病较大的市场规模、产品自身的显著优势以及公司推广力度的加强而进一步提升。
我们预计艾诺韦林片保持较快增长。中国疾控中心发布数据显示,截至2022年底,我国报告存活艾滋病感染者122.3万例,抗病毒治疗覆盖比例超过90%,据国家统计局披露2022年国内新发艾滋病人数为5.3万人,据此预测未来HIV接受治疗的人群规模;根据公司公告,艾诺韦林价格为8.58 元(75mg/片),用法用量为每天一次,一次两片,据此预计每位患者的年治疗费用为6263元。基于公司HIV创新药的竞争格局、疗效和对应适应症人群规模,我们预测2032年艾诺韦林片销售额约为5.4亿元,同比增长3.1%。公司未来希望艾诺韦林片进入免费用药目录,替代支付水平较低的患者。
3.2、艾诺米替片:我国首个有自主知识产权的三合一复方制剂,市场潜力大
艾诺米替片:单片复方制剂,优势显著。艾诺米替片系公司开发的国内首个具有自主知识产权的三联复方单片抗艾滋病1类新药,是在艾诺韦林片(研发代码:ACC007,商品名:艾邦德®)的基础上加入两个核苷类骨干药物——替诺福韦(TDF)和拉米夫定(3TC)所组成的药物。在保障病毒抑制效果的基础上,艾诺米替片作为口服单片复方制剂,HIV感染者每天仅需服用1片,无需再服用其它抗艾滋病药物,可以显著减轻患者服药负担,降低服药场景的识别度,增加依从性,减少耐药发生。与捷扶康开展头对头试验,进展顺利。
2020年7月29日,药监局同意公司就艾诺米替片治疗经治的HIV-1感染者开展III期临床试验,确定了艾诺米替片的III期临床试验方案为与进口原研药物整合酶抑制剂艾考恩丙替片(商品名:捷扶康®,由美国吉利德公司研发,我国首个纳入医保、广泛使用的抗HIV创新单片复方制剂)开展头对头试验。2022年3月末,完成全部762例受试者的入组工作。2023年6月,III期临床试验顺利完成48周主要有效性研究。2023年7月,公司取得艾诺米替片(转换治疗经治获得病毒抑制的HIV-1感染者)III期临床试验总结报告,目前已提交新适应症上市申请。
与艾考恩丙替片相比,艾诺米替片可以持久维持病毒抑制且有效性相当。根据艾诺米替片III期临床试验数据显示,治疗48周时,艾诺米替组HIV-1 RNA 载量≥50 copies/mL(包括时间窗内无病毒学数据)的受试者百分比为1.84%(7/381),艾考恩丙替组则为1.57%(6/381);经基线分层校正,两组百分比差值为0.3%,95%CI [-1.6, 2.1],达成非劣效性。治疗48 周时,艾诺米替组HIV-1 RNA 载量<50 copies/mL 的受试者百分比为98.2%(374/381),艾考恩丙替组则为98.4%(375/381);经基线分层校正,两组百分比差值为-0.3%,95%CI [-2.1, 1.6]。本研究治疗48周无受试者符合耐药检测标准。
截至2024年一季报,艾诺米替片(复邦德®)经治转换III期临床试验48~96周开放扩展期研究取得积极结果。初步结果显示,复邦德®治疗96周病毒学抑制(<50 copies/mL)百分比为96.6%(368/381),此病毒学有效性数据高于进口同类产品治疗96周历史研究数据。对照组艾考恩丙替片(捷扶康®)转换为复邦德®(48~96周)病毒学抑制(<50 copies/mL)百分比为96.6%(364/377),表明整合酶抑制剂艾考恩丙替片转换至艾诺米替片仍可维持高水平病毒学抑制。
同时,捷扶康®转换为复邦德®后体重和低密度脂蛋白胆固醇等指标均发生了积极改善。综上所述,捷扶康®转换为复邦德®可显著改善经治转换HIV人群的体重和低密度脂蛋白胆固醇等指标,且能维持高水平疗效。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)