2024年医药行业趋势分析报告:量价双升机遇
一、复盘过去:泰格医药发展四部曲,本土临床CRO领跑者
泰格医药成立于2004年,通过二十年时间,经过四个发展阶段,成为行业领先的一体化生物医药研发服务平台,为全球制药和医疗器械行业提供跨越全周期的创新研发解决方案。
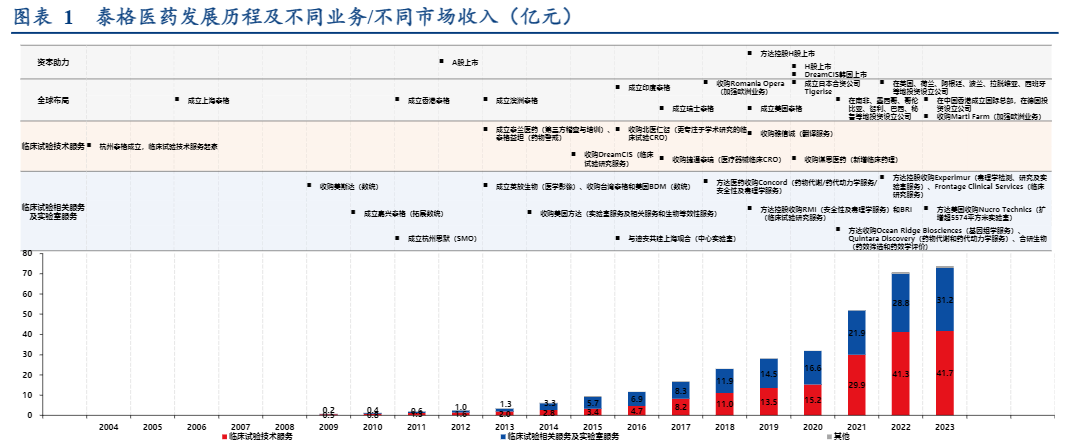
(一)2004-2008年:临床试验技术服务起家,业务能力快速建设
21世纪初,本土CRO公司相继成立,CRO行业逐渐兴起。泰格医药2004年成立,以临床试验技术服务起家。迅速提升专业能力:参照罗氏操作规程(SOP),遵循“没有记录,就没有发生”的临床监察标准,逐步推进临床试验。建设国内网络渠道:2004年在杭州成立并先后在上海、北京、重庆、广州设立服务网点,形成基本组织架构;2005年增设西安服务网点;2006年成立上海泰格,增设成都、南京服务网点;2007年增设长沙、沈阳、武汉服务网点;2008年增设济南、天津、哈尔滨、福州服务网点。在多个城市设立服务网点,一方面能够满足客户在全国开展临床研究的需要,特别是大型的多中心临床试验,另一方面有助于在全国范围内拓展潜在客户。截至2008年末,公司员工人数提升至134人。
(二)2009-2012年:实力壮大,客户资源提升
初步形成国内综合型临床CRO企业:2009年收购美斯达(定位欧美数据统计分析业务),2010年成立嘉兴泰格(定位数据管理与国内/亚太统计分析业务);2011年成立杭州思默,提供临床试验现场管理服务。至此,泰格医药初步形成临床试验技术服务、临床试验相关服务两条业务线,成为国内综合型临床CRO企业。持续快速扩充国内网络渠道:2009年增设郑州、长春、温州、昆明、青岛服务网点;2010年增设南宁、苏州服务网点;2011年成立广州泰格、香港泰格,增设十堰、扬州、无锡等15个服务网点;2012年增设合肥、宁波和台湾服务网点。
截至2011年末,泰格医药与390家临床试验机构开展合作,截至2012年末,泰格医药在国内40+个主要城市设有服务网点,拥有692人的专业服务团队,核心团队成员主要来自跨国药企或国内领先药企的药物研发部门,同时管理团队(经理级别及以上)极其稳定,2009-2011年间仅有两名员工离职。泰格医药服务能力、服务质量再上一层楼。彼时我国药企绝大多数是仿制药厂商,整体新药研究水平较低。为实现经济战略转型,落实《国家中长期科学和技术发展纲要》,2008年国务院批准“重大新药创制”科技重大专项实施方案,“十一五”期间专项资金达到168亿元。
受政策支持、资金扶持和国内医药市场环境变化,我国药企开始重视创新药研究,新药研发投入逐年增加,并出现一批以创新药研发为主要经营目的的企业,但总体研究水平与跨国药企还存在较大差距。恰逢金融危机影响下,跨国药企研发重心向亚太地区战略转移,越来越多企业希望尽快在中国上市新药,而我国《药品注册管理办法》规定,要在中国上市药品必须在国内进行临床试验。与GlobalCRO相比,泰格医药具备明显的价格优势;与其他本土CRO相比,泰格医药是为数不多的能够进行国际多中心试验的本土CRO企业之一,完美契合国外客户进入中国市场时对质量标准和成本因素的双重需求。

该阶段我国开展的临床研究主要分三部分:国内药企注册临床试验、进口注册临床试验、国际多中心临床试验,其中国内药企注册临床试验占比最多(且以仿制药临床试验为主)、国际多中心临床试验占比最少。国内药企注册临床试验市场:2008-2010年泰格医药在中国临床试验CRO市场占有率分别为0.9%、1.5%、2.2%,从绝对值来看并不占优,原因在于本土大多数中小CRO只进行国内药企仿制药报批注册业务,门槛较低但市场容量较大。而公司业务以承接创新药为主要方向,自成立到2011年末公司全部160家国内客户295个临床试验项目中创新药项目数量为93个(占比31.53%)。截至2011年末公司参与了25个新化学单体和10个新生物制品的临床试验,已完成4个创新药临床研究,其中包括抗肿瘤1.1类新药“凯美纳”和抗高血压1.1类新药“艾力沙坦”等。2010年度中国制药工业百强榜前10名药企中6家是公司客户。
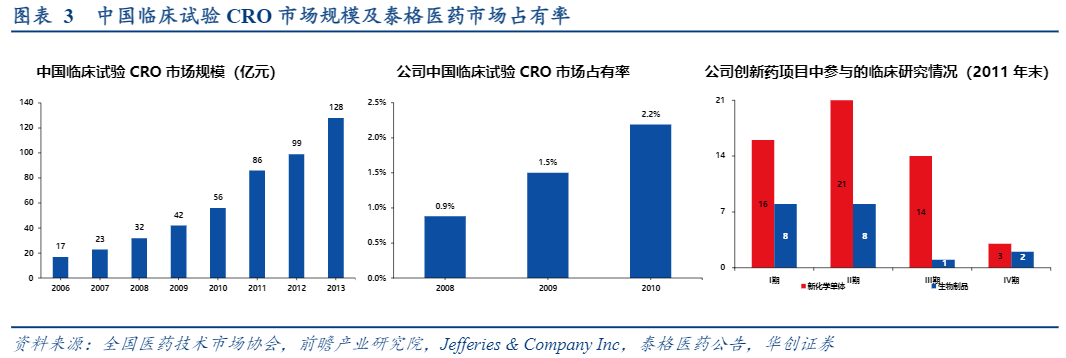
进口注册与国际多中心临床试验市场:泰格医药逐渐与阿斯利康等跨国药企建立长期合作,并在其背书下实现正向循环,公司客户资源也随之迅速提升。截至2011年末公司已完成和正在提供服务的国外医药客户及其在华企业共计144家,进口药相关临床试验项目共计654个,累计参与29项国际多中心研究和33项国际多中心试验批件注册申请。2010年全球前20大制药企业有15家是公司客户,全球前10大生物制药企业有8家是公司客户。公司前五大收入客户也逐渐被跨国药企中国区分公司甚至跨国药企占据。另外2010年公司与日本武田制药株式会社全资子公司新加坡武田临床研究有限公司签署合同,帮助其在中国大陆、中国香港和中国台湾开展国际多中心试验,这是公司首次全权主导在三个地区同时执行的国际多中心试验服务。
国内创新药临床研究和国际多中心试验因其均属创新性研究,覆盖的临床研究机构范围广、数量多,对参与研究的CRO服务水平有很高要求,其中国际多中心试验更是代表药物临床试验开展的最高要求。泰格医药在这两个领域的参与项目和已完成项目均处于本土临床试验CRO前列。泰格医药新增合同签订金额快速提升,带动公司收入迅速提升。另外公司主动向优质客户的大项目侧重,新增合同平均签订金额不断创新高,公司客户结构也大幅调整,逐步向以国内外资客户和国外为主的中高端客户转变。这一转变,也带来了公司毛利率、净利率的跨越式发展,扣非净利润进一步攀升。
(三)2013-2019年:业务版图快速扩张,把握发展机遇实现腾飞
1、公司业务版图快速扩张泰格医药2012年成功于深交所创业板上市,在资本助力下,通过自建或收购,公司业务版图快速扩张,全球网络加速布局。业务版图快速扩张:通过自建或收购拓展/延伸产业链,补全临床试验技术服务和临床试验相关服务(临床试验技术服务:第三方稽查与培训、药物警戒、医学翻译;临床试验相关服务:医学影像),2014年收购方达医药向临床前服务纵向延伸,2017年收购捷通泰瑞向医疗器械临床CRO横向拓展。全球网络加速布局:国内网络渠道进一步扩充,截至2019年末,公司已有123个国内服务网点(含中国香港、中国台湾),覆盖全国800多家药物临床试验机构。
海外网络加速布局,2013年通过自建或收购先后在澳大利亚、韩国、新加坡、马来西亚、加拿大、美国等地设立分支机构;2015年收购韩国较大规模的临床CRO公司DreamCIS;2016年成立印度泰格;2017年成立瑞士泰格;2018年收购罗马尼亚Opera。截至2019年末,公司在亚太、北美、欧洲等地区的10个国家设立海外子公司。2、中国临床CRO行业需求旺盛的同时对质量要求更高进口药物临床CRO需求调整后迎来飞升2014年CDE逐步开始对外资药进口注册实施“三报三批”,即在国内完成国际多中心临床的进口药在国内注册申报时必须增加一道申报程序(申请时间约2年),进口药申报节奏整体往后挪2年。
政策影响下,进口临床申请项目数量有所减少,但经2年左右时间调整,审批节奏恢复正常。2017年中国正式加入ICH,成为其全球第8个监管机构成员,临床试验监管逐渐与国际接轨。2017年10月NMPA公布《关于调整进口药品注册管理有关事项的决定》,对进口药品注册管理有关事项进行调整,鼓励国外在研新药在国内同步开展临床试验,国际临床试验项目逐渐向中国转移。国产创新药及产业链短期阵痛后迎来崛起大时代2014年前后几年中国医药研发投入年复合增速高达30%。
但当时我国临床研究领域存在诸如研究质量不高、研究能力不足、研究行为不规范甚至弄虚作假的现象。在此背景下,监管重要性凸显。药政改革带给临床CRO的是挑战更是机遇。2015年7月22日NMPA发布《关于开展药物临床试验数据自查核查工作的公告》,严厉打击临床数据造假、临床不规范行为,行业迎来短期阵痛,但换来临床试验质量标准的提升、积压的等待批文的药物申请的清理,为我国创新药上市创造有利的审评环境。
2016年6月国务院办公厅印发《药品上市许可持有人制度试点方案》,允许药品上市许可持有人与生产企业分离,有利于产业结构调整和资源优化配置,鼓励轻资产研发型企业,促进医药研发企业积极性和科研机构研究成果转化。2017年NMPA发布三项政策文件,再次加大对创新药研发支持力度。2018年11月发布《4+7城市药品集中采购文件》,仿制药行业洗牌,政策进一步驱动创新药加速升级。我国生物医药领域融资数量和金额快速提升,创新药研发热情火爆,一批海归创业biotech在资本助力下快速推进研发管线,叠加2018年国内A股科创板开通以及港股18A上市规则修订,未盈利Biotech退出机制完善,进一步促进一级市场投资。
而一批传统药企在政策影响下也开始大幅增加研发投入,向创新转型升级。我国创新药迎来崛起大时代,新药临床试验登记数量快速上升,在药企综合考虑研发风险、控制成本和提升效率下,临床CRO渗透率持续提升,另外Biotech对临床CRO依赖度更高,临床CRO需求旺盛。中国临床CRO市场迎来高速发展。而临床试验质量标准的不断提升,使得临床CRO行业门槛提高,行业出现优胜劣汰,集中度提高,利好国内头部公司。
3、公司把握发展机遇,成长为中国临床CRO绝对龙头2014-2016年:平稳度过政策调整期2014年国外临床试验技术服务订单受政策影响,公司及时调整思路战略转型。一方面积极发展国内创新药优质客户,另一方面大力发展不受政策影响的数统,同时收购方达医药(向临床前服务纵向延伸)、上海晟通(物流运输)等,对公司业绩增厚产生积极影响。2015年下半年起国内开始进行大规模自查核查工作,受此影响,公司大力发展数统等临床研究相关咨询服务,整体收入增速维持在较高水平。2015年公司顶住压力追赶项目进度,提高工作效率,完成年初目标,临床试验技术服务收入同比增长22%,而2016年收入同比增长10%(扣除并购影响),但受自查核查带来的项目工作量和成本增加影响以及并购韩国DreamCIS,临床试验技术服务毛利率下滑15.57pct,使得2016年整体扣非净利润下滑33%,自上市以来首次下滑。
而后政策对公司影响逐渐消除。2016-2019年:把握发展机遇,实现腾飞公司凭借全面的服务和不断扩大的全球布局、行业领先的质量标准和项目交付能力、广泛优质且忠诚的客户基础,脱颖而出。截至期末运行中的药物临床研究项目数量:2017年218个,2019年287个;截至期末累计参与的国内创新药临床试验数量:2015年58个,2018年166个;2019年获批的13个中国1类新药中,7个由泰格医药或子公司助力研发;截止期末运行中的国际多中心临床试验项目数量:2017年6个,2019年12个。与之相匹配的是,公司迎来收入和利润的快速增长。
细分来看,公司临床试验技术服务、临床试验相关服务及实验室服务收入齐开花;国内和海外收入齐开花,其中国内收入占比自2014年以来呈现快速上升趋势。一组数据感受泰格医药速度。从2012到2019年,公司人员翻7.2倍,人效翻1.6倍,收入翻11倍,扣非净利润翻9倍。
泰格医药国内临床CRO绝对龙头地位奠定。据Frost & Sullivan,2019年全球临床CRO市场CR10=65%,公司是唯一一家总部位于中国的临床CRO;2019年中国临床CRO市场CR5 = 31%,公司是中国最大的临床CRO,2019年市场份额8.4%。2019年,公司为全球排名前20的所有制药公司和中国收入排名前10的制药公司提供了服务。
(四)2020-2023年:全面提升全球布局和服务能力,向国际性CRO迈进
2019年5月30日子公司方达控股于香港联交所上市,2020年8月7日公司于香港主板联交所上市,2020年5月22日旗下DreamCIS于韩国证券期货交易所上市,为全球化及业务拓展提供资金支持,公司全球布局持续深化。国内:药物临床研究服务业务在中国内地主要城市、中国香港和中国台湾设立的服务网点数量从2019年123个提升至2023年150+个,覆盖国内大部分大中型城市,开展合作的临床试验机构数量从2019年800+家提升至2023年1380+家。
海外:公司持续加大海外投入。一方面,在全球多个国家布局子公司并组建本地临床团队,招聘熟悉各国药政法规和临床实践的专业人员,建立同步运营和协作机制,具备同步执行全球化项目的能力;另一方面,收购海外CRO扩大服务海外客户和出海客户的运营能力。美国地区:截至2023年末,美国临床运营服务建立包括中心启动、项目管理、临床运营、法规注册、数统、医学监查等综合一体化平台和完整的运营团队,包括布局在美国和加拿大42个城市的超过110位PM和CRA。
欧洲/中东/非洲地区:2023年收购克罗地亚CRO公司Marti Farm并完成和罗马尼亚Opera的业务和体系整合,形成一体化临床运营服务平台,并在EMEA(欧洲/中东/非洲)地区新成立医疗器械团队。亚太地区:截至2023年末,韩国团队(DreamCIS)规模达到369人,同比增长28%;东南亚临床运营团队超70人,布局在印尼/菲律宾/新加坡/泰国/越南/马来西亚/老挝。截至2023年末,全球员工数量达9701人,其中CRA 950+,CRC 2700+,数统团队850+,实验室团队1700+,覆盖全球五大洲28个国家。国内员工8069人,较2019年末增长88.5%,海外员工1632人,较2019年末增长140.4%。
全球服务能力的提升需要实现接洽客户、拿到项目、执行项目&积累经验、优质高效完成项目、提升客户信任、扩大公司影响力的正向循环,而临床试验的长周期注定了完成上述循环的慢节奏。借力新冠实现全球服务能力的跃迁。2021年,公司作为国内首款获批腺病毒载体新冠疫苗Ad5-nCoV国际多中心III期临床研究牵头临床CRO,在巴基斯坦、墨西哥、俄罗斯、智利及阿根廷5个国家开展研究。2022年,公司助力4个新冠疫苗成功获得海外或中国紧急使用授权。海外疫苗国际多中心临床项目总入组人数超过14万人,覆盖亚太、欧洲、拉丁美洲、非洲的十余个国家。公司参与了多个新冠疫苗/治疗方法的大型MRCT项目管理和运营,在复杂的疫情形势下,在各大洲之间进行无缝协调,从而提供优质高效服务,加速提升多区域临床试验执行能力,增加全球项目管理经验,拓展海外注册与法规事务服务覆盖的新区域,提高内部标准操作规范(SOPs)和质量保证标准,扩大全球影响力。
2019-2023年,公司截至期末运行中的药物临床研究项目数量持续增长,2023年达到752个,其中499个项目在境内开展,253个项目在境外开展。2019-2023年,公司截至期末运行中的海外单一区域、多区域临床研究项目数量实现跨越式增长。2023年末运行中的253个境外开展项目中,194个项目在境外(包括韩国、澳大利亚及美国)进行单一区域临床试验,59个项目在亚太地区、北美洲、欧洲及非洲进行多区域临床试验(2023年数据小幅下滑主要是因为韩国和拉丁美洲地区2023年下半年结束多个包括个别新冠疫苗在内的项目)。美国地区:截至2023H1末进行中的临床试验项目40+个(包括单区域和MRCT),截至2023年末临床运营项目经验100+个,与美国45个州500+家临床研究中心开展合作。EMEA地区:2022年启动了首个覆盖欧洲多国的肿瘤MRCT项目。截至2023H1末进行中的临床试验项目35个(包括医疗器械临床和MRCT)。亚太地区:截至2023年末韩国团队进行中的临床项目100+个,东南亚进行中的临床试验项目24个,澳大利亚地区新增临床试验项目20个,并与更多澳洲临床机构展开合作。
2019年末MRCT累计项目经验数量12个,2023年末127+个。2022年末累计在全球49个国家/地区执行过MRCT。2022年公司MRCT新签项目21个,2023年15个。公司新签合同签订金额自2021年实现大基数下的高增长后维持在高位,2023年下降18.8%主要是因为:1、2023Q4部分客户取消订单或发生金额为负的合同变更;2、新签订单中过手费同比大幅下降,但值得注意的是,公司仍获得较多优质订单,尤其是来自跨国药企和本土制药公司的订单,公司在海外市场商务拓展取得一定成绩,北美市场新签订单和业务均实现快速增长。公司期末累计待执行合同总额持续增长。
本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。