2024医药行业报告:国产创新药国际舞台亮相分析
01. 国产ADC百花齐放
科伦药业:SKB264 (TROP2 ADC)
背景:
TROP2(滋养细胞表面抗原2)在非小细胞肺癌(NSCLC)中普遍过表达,并与不良预后相关。SKB264是一种新型抗TROP2 ADC,使用磺酰基嘧啶- cl2a -碳酸酯连接剂偶联其 有效载荷(belotecan衍生物拓扑异构酶I抑制剂),平均药抗比(DAR)为7.4。设计目的是在循环稳定性和肿瘤细胞中ADC有效载荷的释放之间实现更有效的平衡。本次ASCO 会议公司报告了SKB264治疗非小细胞肺癌患者的临床疗效和安全性结果。采用免疫组化方法回顾性评价TROP2的表达水平。将提供响应与TROP2水平之间的相关分析。
方法:
这是一项针对复发或难治性局部晚期/转移性NSCLC和其他肿瘤类型的患者的1/2期多中心剂量递增/扩展研究。所有NSCLC患者接受5 mg/kg IV Q2W剂量的SKB264治疗。研究人员每8周进行一次基于RECIST 1.1的肿瘤评估。
结果:
截至2023年2月9日,纳入43例患者(63%男性,88% ECOG ps1,中位年龄58岁[44-74])。中位随访时间为11.5个月(mo;95% ci, 10.4-12.2)。中位治疗时间为5.7个月(范 围0.5-14.1)。在39个可评估反应的患者中,ORR为44%(17/39,15例确认,2例待确认),中位DoR为9.3个月(范围,1.3+至11.2+),6个月DoR率为77%。对于EGFR野生 型亚组(此前接受中位2线治疗,包括抗pd -1/L1), ORR为26% (5/19),DCR为89%(17/19),中位PFS为5.3个月,9个月OS率为80.4%。对于TKI耐药EGFR突变NSCLC亚 组(50%也至少有一线化疗失败),ORR为60% (12/20),DCR为100%(20/20),中位PFS为11.1个月,9个月PFS率为66.7%。
67.4%(29/43)的患者出现≥3级治疗相关不良事件(TRAEs)。最常见的≥3级TRAEs(发生率≥5%)是中性粒细胞计数减少(32.6%)、贫血(30.2%)、白细胞计数(WBC)减少 (23.3%)、口腔炎(9.3%)、皮疹(7.0%)和淋巴细胞计数减少(7.0%)。4级TRAEs仅发生于中性粒细胞减少和白细胞减少。大多数血液学毒性发生在治疗的前两个月内,在不输 血的情况下给予粒细胞集落刺激因子或促红细胞生成素治疗后消退。23.3%(10/43)的患者因TRAEs而出现剂量减少。没有神经病变或药物相关性ILD/肺炎的报道。没有 TRAEs导致治疗中断或死亡。
结论:
在复发或难治性局部晚期/转移性NSCLC患者中,5 mg/kg Q2W的SKB264显示出令人鼓舞的抗肿瘤活性和可控的安全性。TRAEs主要是血液学。SKB264在晚期非小细胞 肺癌患者中的III期研究已在计划中。
临床试验信息:NCT04152499。
百利天恒:BL-B01D1(EGFR / HER3 ADC)
背景:
BL-B01D1是一种新型ADC,由EGFRxHER3双特异性抗体组成,通过可切割连接物与新型TOP-I抑制剂有效载荷连接。本次ASCO会议上公司公布了来自FIH I期研究的BL-B01D1的安全性/有效性结果。
方法:
该研究纳入了局部晚期或转移性实体瘤患者。对于剂量递增(D-ESC, i3+3), BL-B01D1以0.27,1.5,3.0 mg/kg QW, 2.5, 3.0, 3.5mg/kg D1D8 Q3W或4.5,5.0,6.0 mg/kg D1 Q3W静脉注射。一部分患者被纳 入Q3W方案的剂量扩展(D-EXP)。
结果:
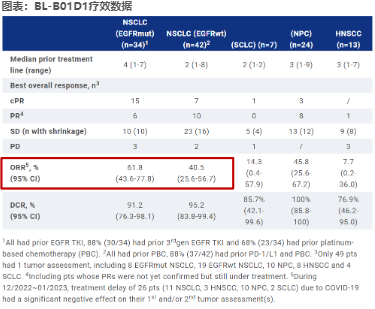
截至2022年12月31日,150名患者入组并接受了至少一剂(D-ESC, n=25;D-EXP, n = 125)。在3.0mg/kg QW和3.5mg/kg D1D8 Q3W时,DLT为中性粒细胞减少症、发热性中性粒细胞减少症和血小板减少症。测定MTDs分别为3.0mg/kg D1D8 Q3W和6.0mg/kg D1 Q3W。分别以2.5、3.0mg/kg D1D8 Q3W和 4.5、5.0、6.0 mg/kg D1 Q3W进行D-EXP试验。144名患者在所有Q3W剂量水平(D-ESC和D-EXP)中入 组,包括89名NSCLC, 7名SCLC, 27名鼻咽癌(NPC), 19名HNSCC和2名其他类型。最常见的TRAEs (所 有等级/3级及以上)为白细胞减少(60%/30%)、中性粒细胞减少(51%/34%)、贫血(45%/15%)、血小板减 少(44%/19%)、脱发(30%/0%)、恶心(29%/<1%)、呕吐(28%/0%)、虚弱(21%/<1%)、食欲减退 (22%/<1%)、乏力(21%/<1%)、吞咽(16%/0%)、腹泻(15%/2%)、口腔溃疡(15%/<1%)、皮疹 (13%/0%)。未观察到ILD。122例PTS可评估疗效(至少1例肿瘤评估)。PK等细节会在会议中更新。
结论:
BL-B01D1在大量预处理的转移性/局部晚期实体瘤中表现出令人鼓舞的疗效,特别是在EGFRm NSCLC患 者中。安全概况显示足够的安全性和耐受性。
石药集团:SYSA1801(CLDN18.2 ADC)
背景:
SYSA1801是一种靶向claudin 18.2 (CLDN18.2)的MMAE抗体-药物偶联物(ADC), claudin 18.2是一种广泛表达于胃、胰腺和其他实体肿瘤的紧密连接蛋白。CLDN18.2 具有高度选择性的细胞表面表达谱,仅限于正常胃粘膜,使其成为有希望的ADC治疗靶点。SYSA1801在表达CLDN18.2的多种细胞系和患者来源的异种移植物中显示出显 著的体外和体内抗肿瘤活性。
方法:
这是一项开放标签、多中心、I期研究,旨在评估SYSA1801在组织学上证实的表达CLDN18.2的耐药/难治性实体肿瘤患者(pts)的安全性、耐受性、药代动力学和疗效,这 些患者对标准治疗进展或不耐受,或没有标准治疗。本研究由两部分组成;第一部分是修改后的3+3剂量递增设计,每3周(Q3W)静脉注射SYSA1801 5个剂量水平(0.5、1、2、2.5和3mg /kg),然后在有效剂量下进行剂量扩展。第2部分是在最佳剂量下的队列扩展。本次ASCO会议上,公司给出第1部分中SYSA1801的初步结果。
结果:
截至2022年11月5日,33名患者入组,中位年龄为59岁(范围22-71岁),在第一部分中接受SYSA1801 3mg /kg。胃癌26例(78.8%),胰腺癌7例(21.2%)。5例患者ECOG PS为0(15.2%),28例患者ECOG PS为1(84.8%)。11名患者(33.3%)进行了大量预处理(≥3条既往线)。
25名患者(75.8%)发生了任何级别的治疗相关不良事件(TRAEs),其中8名患者(24.2%)≥3级。无治疗相关死亡报告。最常见的TRAEs(占20%)是恶心(42.4%)、呕吐(36.4%)、干眼综合征(21.2%)和贫血(21.2%)。3 mg/kg剂量组发生2例DLT(3级恶心和呕吐)。目前正在探索SYSA1801的最佳剂量。
在入组的33名患者中,21名患者可根据RECIST v1.1评估疗效。客观缓解率(ORR)为38.1% (95% CI: 18.1-61.6%, 8 PR),疾病控制率(DCR)为57.1% (95% CI: 34.0-78.2%,4 SD)。在17例GC可评估患者中,ORR和DCR分别为47.1% (95% CI: 23.0-72.2%, 8 PR)和64.7% (95% CI: 38.3-85.8%, 3 SD)。1例GC患者接受SYSA1801治疗,剂量 为1mg /kg, Q3W,耐受治疗44周,在分析时证实持续部分缓解。另一名GC患者此前抗CLDN18.2治疗失败,在SYSA1801 2 mg/kg IV Q3W上获得了确认的PR。
结论:
SYSA1801在表达cldn18.2的耐药/难治性实体瘤(尤其是胃癌)患者中显示出良好的早期疗效迹象和良好的耐受性安全性。研究的第一部分正在进行中,第二部分将在中国确 定最佳剂量后开始;Elevation Oncology正在计划在大中华区以外包括美国的研究。
临床试验信息:NCT05009966。
翰森制药:HS-20093
背景:
B7H3是B7超家族的一员,在各种实体肿瘤中高表达,但在正常组织中表达有限,低水平表达。HS-20093是一种B7H3靶向抗体-药物偶联物。对于晚期实体瘤,特别是那 些在多线治疗中失败、需要新的和更有效的治疗方法的患者,是一个有吸引力的治疗选择。
方法:
这是HS-20093治疗晚期实体瘤(NCT05276609)的首次人体、多中心、开放标签I期研究。剂量递增部分评估了静脉注射HS-20093的安全性和耐受性,剂量范围为1.0至 16.0 mg/kg。剂量递增计划采用加速滴定和间隔3+3设计。晚期实体瘤患者需要先前接受过标准治疗。HS-20093每3周静脉给药一次。
结果:
截至2022年12月20日,该研究完成了所有计划剂量队列(1.0至16.0 mg/kg)。在剂量递增研究中,53例多种肿瘤类型患者接受了≥1剂量的HS-20093治疗,其中29例为非 小细胞肺癌,11例为小细胞肺癌(SCLC), 9例为肉瘤,4例为其他晚期实体瘤。在基线时,25名患者(47.2%)接受了≥3条既往治疗线,平均为3.2(范围,1-12)条既往治疗线。
3例患者出现剂量限制性毒性(1例为12.0 mg/kg;2 PTS (16.0 mg/kg)。最大耐受剂量为12.0 mg/kg。53例(100%)患者出现治疗不良事件(TEAE)。总体而言,≥30%的患 者最常见的TEAE是白细胞减少、中性粒细胞减少、贫血、发热、恶心、血小板减少、低白蛋白血症、呕吐、淋巴细胞减少、输液相关反应和疲劳。无间质性肺疾病报告。
无论基线B7-H3表达水平如何,在40例可评估反应的患者中,在接受HS-20093从4.0 mg/kg到12.0 mg/kg剂量治疗的患者中,观察到14例PR(35.0%),包括9例已确认 的PR和5例等待确认的PR。疾病控制率为85.0% (34/40,95% CI: 70.2 ~ 94.3)。治疗时间最长的患者(349天)仍在治疗。在9例SCLC患者的亚组中,观察到7例PR(77.8%),中位缓解深度为50.5%,其中3例已确认PR, 4例待确认PR。SCLC患者的所有反应都发生在第一次疾病评估时;到首次反应的中位时间为6周。HS-20093在先前接受喜树碱 衍生物治疗的SCLC患者中显示出抗肿瘤活性。
结论:
HS-20093的安全概况是可接受的。HS-20093在多种肿瘤类型中显示出良好的抗肿瘤活性,特别是在SCLC中。HS-20093在特定肿瘤类型中的有效性和安全性的进一步剂 量扩大研究正在进行中。
临床试验信息:NCT05276609。
同宜医药: CBP-
背景:
前列腺特异性膜抗原(PSMA)或叶酸水解酶1 (FOLH1)在前列腺癌中高表达,叶酸受体α (FRα)在各种恶性组织中过表达,均与肿瘤侵袭性有关。CBP-1018是一种以单甲基 aurisatin E (MMAE)为有效载荷靶向PSMA和FRα的双配体药物偶联物。
方法:
该1期研究包括剂量递增和扩展阶段。在剂量递增阶段,单个患者以0.03mg/kg加速滴定,剂量水平(DLs)≥0.06 mg/kg时采用i3+3设计,每4周1次。该阶段主要为转移性 去势抵抗性前列腺癌(mCRPC)患者(pts),既往治疗中位数为3.5线。主要目的是评估安全性和耐受性,确定剂量限制毒性(DLT)和最大耐受剂量(MTD)。此外,还将评估药 代动力学(PK)和初步疗效。
结果:
截至2022年11月24日,14名患者(12名mCRPC患者,1名膀胱癌患者和1名输尿管癌患者)被纳入5个剂量组(1名患者0.03 mg/kg, 3名患者各0.06,0.08,0.10 mg/kg, 4名患 者0.12 mg/kg)。未观察到DLT或药物相关死亡。9名患者(64.3%)出现治疗相关不良事件(TRAEs)≥3级,最常见的是中性粒细胞减少(35.7%)、白细胞减少(28.6%)、淋巴细 胞减少(14.3%)、GGT升高(14.3%)和高甘油三酯血症(14.3%)。
在10例可评价mCRPC疗效的患者中,3例在剂量为0.08、0.10和0.12mg/kg时观察到SD, 4例在剂量为0.06、0.10和0.12mg/kg时观察到非PD, 3例在0.06和0.08 mg/kg时 观察到PD。在0.10 mg/kg的剂量下,3名患者的前列腺特异性抗原(PSA)下降。总体中位PFS为7.2个月(95%CI, 1.7-9.3), mCRPC患者未达到PFS。CBP-1018和游离 MMAE的PK谱t1/2z分别为0.54 ~ 1.15 h和40.28 ~ 57.27 h,多次给药后两种物质均无积累。
结论:
CBP-1018在无dlt的情况下,DLs为0.03-0.12 mg/kg Q2W时耐受性良好。在DLs为0.08-0.12 mg/kg时观察到多个SD,这赋予了mCRPC患者有希望的初步抗肿瘤活性。尚未达到中期目标,正在继续增加剂量以建立RP2D。
临床试验信息:NCT04928612。
映恩生物:DB-1303(HER2 ADC)
背景:
DB-1303是一种抗体-药物偶联物(ADC),由人源化抗her2 IgG1单克隆抗体组成,通过基于马来酰亚胺四肽的可切割连接物与专有的DNA拓扑异构酶I抑制剂(P1003)共价 连接,具有高药抗比(DAR~8)。
方法:
这是一项针对晚期/转移性实体瘤患者的全球首次人体剂量递增和扩展研究。招募先前全身治疗失败的HER2 -(高或低)表达或突变癌症患者(ECOG 0-1),并接受DB-1303静 脉注射Q3W作为单药治疗。目的是安全性、耐受性、最大耐受剂量或推荐2期剂量、药代动力学和初步抗肿瘤活性。本次ASCO会议公司报告了剂量递增的结果。
结果:
截至2023年1月13日,85名患者接受了6种剂量水平(2.2、4.4、6.0、7.0、8.0和10.0 mg/kg)的DB-1303治疗,中位既往接受7线治疗(范围1-27),包括32.9%的患者接受 过抗HER2 ADC治疗。中位治疗持续时间为63.0天(范围21-211),68名患者(80.0%)仍在接受治疗。治疗中出现的不良事件(TEAE)和≥3级TEAE分别为74例(87.1%)和18例 (21.2%);最常见的TEAE为恶心(51.8%,3.5%≥G3)、呕吐(43.5%,1.2%≥G3)、血小板计数减少(35.3%,3.5%≥G3)和贫血(29.4%,5.9%≥G3)。少数患者出现中性粒细胞 减少(10例[11.8%])和脱发(3例[3.5%])。没有导致死亡的DLT或TEAE。2名患者(2.4%,G1)发生间质性肺疾病,无≥G2病例。DB-1303 ADC的暴露参数(Cmax和AUC)随剂 量的增加而增加,从2.2 mg/kg增加到10.0 mg/kg。在6.0-8.0 mg/kg剂量组中,DB-1303 ADC的半衰期约为6-7天。血清释放载荷暴露比DB-1303 ADC低数量级,表明 ADC在体循环中的稳定性。
总共52名患者接受了至少一次基线后肿瘤扫描。根据RECIST 1.1标准,23例患者(44.2%,23/52)有客观部分肿瘤缓解:包括13例HER2阳性乳腺癌(BC)(50.0%,13/26,包 括5例脑转移[55.6%,5/9]),5例HER2低表达乳腺癌(38.5%, 5/13), 2例结直肠癌(66.7%,2/3),1例子宫内膜癌(33.3%,1/3),1例食管癌(50.0%,1/2),1例卵巢癌 (50.0%,1/2)。所有患者的DCR为88.5% (46/52);对于HER2+ BC和HER2低BC的患者,DCR分别为96.2%(25/26)和84.6%(11/13)。
结论:
DB-1303在重度预处理的晚期/转移性实体瘤患者中具有良好的耐受性和令人鼓舞的初步抗肿瘤活性,特别是在HER2+ BC和脑转移以及HER2低BC患者中。在RP2D治疗的 选定肿瘤患者中正在进行扩张。
临床试验信息:NCT05150691。
诗健/联宁:ESG401(TROP2 ADC)
背景:
ESG401是一种创新ADC,由人源化抗TROP2 IgG1单克隆抗体通过专有的稳定可切割连接物偶联拓扑 异构酶I抑制剂SN-38组成,DAR为8。
方法:
年龄≥18岁的局部晚期/转移性实体瘤难治/复发,伴有可测量的疾病(RECIST v1.1)。ESG401按指定剂 量和方案静脉给药,直至出现不可接受的毒性或疾病进展。采用贝叶斯最优区间(BOIN)设计建立MTD。
结果:
截至2023年2月3日,35名中位年龄为53岁的患者接受了≥1剂量的ESG401治疗,剂量为2-20mg/kg Q3W一次(方案A),或12-16mg/kg D1,8,15, 4周周期(方案B)。80%的患者ECOG = 1, 63%的患者为3L+,中位经过4线治疗(2-10),基线时94%患者有内脏转移(11%脑,63%肝,60%肺)。只有1例20mg /kg的患者出现DLT。MTD 尚未达到两种方案。最常见的TRAEs是白细胞减少(80%)、中性粒细胞减少(69%)、贫血(66%)、疲劳(54%)、恶心(51%)和呕吐(46%)。最常见的≥3级TRAEs是白细胞减 少症(29%)和中性粒细胞减少症(31%)。无≥3级血小板减少症、腹泻、皮疹或口腔黏膜炎。无间质性肺疾病(ILD)。
在33例可评估疗效(EE)患者中,观察到12例部分缓解(PR), 4例达到SD≥24周。在16 mg/kg Q3W发现PR,随后作为治疗相关剂量(TRD)。在TRD患者中,11例TNBC患 者的ORR和DCR分别为36%(4/11)和64%(7/11),而13例HR+/HER2-BC患者的ORR和DCR分别为62%(8/13)和77%(10/13)。两名脑转移的患者均获得了明显的颅内反 应(其中一名患者的颅内病变明显缩小到小到无法测量)。截至2023年2月3日,11例(31%)患者仍在接受治疗。3例患者治疗超过12个月,最长治疗时间为12.9个月。一名 患者的PR持续到10.8个月。
结论:
初步数据表明,ESG401在重度预处理患者中是安全且耐受性良好的,具有良好的疗效信号。这些令人鼓舞的发现值得进一步的临床评估。
临床试验信息:NCT04892342。
吉利德:戈沙妥珠单抗(TROP2 ADC)
背景:
HR+/HER2 - mBC的治疗包括序贯内分泌治疗(ET)联合靶向药物,然后是序贯单药化疗(CT),这与预后和生活质量差有关。SG是一种TROP-2导向的抗体-药物偶联物,已 在多个国家批准用于既往接受过≥1次全身治疗的转移性三阴性乳腺癌患者,并在美国批准用于HR+/HER2-经治的mBC经治的患者。在TROPiCS-02 III期研究中,SG在第 二次计划的中期OS分析中显示,与医生选择治疗(TPC)相比,经治的内分泌治疗耐药HR+/HER2 - mBC患者的OS获益具有统计学意义,390例事件数中,中位数OS为14.4 个月 vs 11.2个月;HR, 0.79 [95% ci, 0.65-0.96];P = 0.02;Rugo HS,等。ESMO 2022。LBA76);这被认为是方案的最终分析。本次ASCO会议上,公司报告了TROPiCS-02 中位随访时间较长的OS探索性分析结果(12.75个月)。
方法:
先前接受紫杉烷、ET、CDK4/6抑制剂和2-4次化疗治疗的符合条件的hr +/HER2 - mBC患者被随机分配为1:1,接受SG (10 mg/kg IV d1和8次,每21 d一次)或TPC,直 到疾病进展或不可接受的毒性。主要终点是根据RECIST v1.1进行的盲法独立中心评价的无进展生存期。主要次要终点包括操作系统和安全性。在探索性分析中,通过 HER2免疫组织化学(IHC)评估OS。
结果:
总共543例(mBC的中位既往化疗线数为3;内脏转移患者95%)随机接受SG (n=272)或TPC (n=271)。截至2022年12月1日,共发生437例OS事件(中位随访12.75个月),自第二次计划的中期分析以来,SG组与TPC组新增死亡47例(8.7%)(22例[8.1%]对25例[9.2%])。在这次延长的随访中,SG继续表现出与TPC相比OS的改善(中位数OS 14.5 个月 vs 11.2个月;HR, 0.79 [95% CI, 0.65-0.95];名义P = 0.01)。12个月时SG与TPC的OS率(95% CI)分别为60.9%(54.8-66.4)和47.1%(41.0-53.0),18个月时分别为 39.2%(33.4-45.0)和31.7%(26.2-37.4),24个月时分别为25.6%(20.4-31.1)和21.1%(16.3-26.3)。总体而言,92%的患者可通过IHC评估HER2状态,其中HER2 IHC0患者 217例,HER2-low患者283例,SG均显示出OS改善,在HER2 IHC0 患者中中位数OS为13.6个月vs 10.8个月(HR, 0.86 [95% CI, 0.63-1.13]),在HER2-LOW患者中,中位OS为15.4 vs 11.5个月(HR, 0.74 [95% CI, 0.57-0.97)。更新的安全性将在演示时报告。
结论: TROPiCS-02研究的最终OS分析证实了SG比单药CT在预处理的内分泌抵抗性HR+/ HER2-mBC患者中具有临床意义的OS优势。这种改善与her2低状态无关。这一分 析强化了SG作为一种有效和安全的治疗方法,适用于治疗选择有限的pt人群。
临床试验信息:NCT03901339。
第一三共:DS-8201 (HER2 ADC)
背景:
T-DXd (6.4 mg/kg,每3周[Q3W])在DESTINY-CRC01的HER2+ mCRC患者中显示出抗肿瘤活性。公司报告了 DESTINY-CRC02 (NCT04744831)的初步结果,评估了T-DXd(5.4和6.4 mg/kg)对HER2+ mCRC患者的疗效和 安全性。
方法:
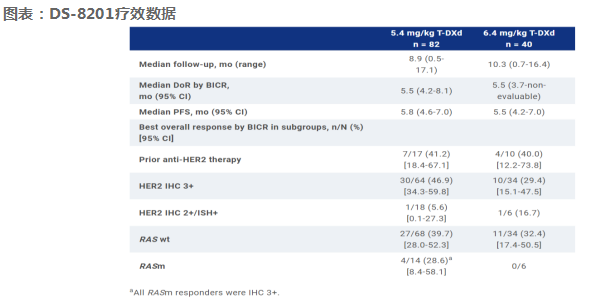
这是一项多中心二期研究。符合条件的患者有中央确认的HER2+(免疫组织化学[IHC] 3+或IHC 2+/原位杂交 [ISH]+) mCRC。具有RAS野生型(wt)或突变型(m) mCRC的患者符合条件。除非有禁忌症,否则患者之前接受过 标准治疗;允许既往抗HER2治疗。在第一阶段,80名患者按1:1随机分配到5.4 (n = 40)或6.4 (n = 40) mg/kg T-DXd截至2022年11月1日,5.4和6.4 mg/kg T-DXd组的大多数患者患有HER2 IHC 3+(78.0%和85.0%),RAS wt肿瘤(82.9%和85.0%),中位分别经过3线和4线治疗。5.4 mg/kg组的cORR为37.8% (95% CI, 27.3-49.2%), 6.4 mg/kg组的cORR为27.5% (95% CI, 14.6-43.9%)(两组均部分缓解)。关键疗效数据见表。
在5.4和6.4 mg/kg T-DXd组中,分别有41/83名患者(49.4%)和23/39名患者(59.0%)观察到≥3级治疗不良事件(ae)。在5.4 mg/kg组和6.4 mg/kg组中,分别有 20/83(24.1%)和12/39(30.8%)患者出现严重不良反应。独立判定的药物相关性间质性肺病发生在5.4 mg/kg T-DXd组的7/83名患者(8.4%)和6.4 mg/kg T-DXd组的5/39 名患者(12.8%),大多数事件为1/2级(6.4 mg/kg组1例5级)。
结论:
T-DXd在5.4和6.4 mg/kg剂量的HER2+ mCRC患者中显示出有希望的抗肿瘤活性。在5.4 mg/kg T-DXd和先前接受过抗her2治疗的患者中,无论RAS突变状态如何,均 观察到抗肿瘤疗效。总的来说,安全性与已知的T-DXd的安全性一致,并倾向于5.4 mg/kg的剂量。
临床试验信息:NCT04744831。
第一三共:DS-8201 (HER2 ADC)
背景:
尽管一线(1L)免疫治疗±CT取得了进展,但大多数晚期NSCLC患者都经历了疾病进展,需要新的治疗策略。Dato-DXd是一种抗体药物偶联物(ADC),由人源化抗TROP2 IgG1单克隆抗体组成,通过血浆稳定的四肽基可切割连接物与拓扑异构酶I抑制剂有效载荷共价连接。Dato-DXd在重度经治的晚期NSCLC中具有令人鼓舞的疗效和可管理 的安全性。Dato-DXd+免疫治疗比单独使用任何一种药物产生更大的临床前活性。
方法:
TROPION-Lung02 (NCT04526691)是一项1b期全球性剂量递增和扩展研究,在6个队列中每21天评估一次Dato-DXd(4或6 mg/kg) + pembro 200 mg±Pt-CT(顺铂75 mg/m2或卡铂AUC 5)。剂量爬坡的患者可以接受≤2线的aNSCLC治疗。剂量扩张期的患者主要为初治患者(接受Dato-DXd + pembro的患者可能有≤1次基于含铂治疗。主要目的是评估安全性和耐受性,包括剂量限制性毒性(DLT)。次要目的包括评价疗效、药代动力学和免疫原性。
结果:
截至2022年10月31日数据截止, 120例患者接受了治疗。所有队列均符合DLT剂量爬坡标准。中位年龄为65岁。PD-L1表达为<1%、1%-49%和≥50%的比例分别为40%、33%和26%。中位治疗持续时间为4.6个月,55%的患者在数据截止时接受治疗。最常见的任何级别TEAE是恶心(45%)和口炎(45%)。61%的患者发生≥3次TEAE;最常见的 是中性粒细胞计数下降(8%)和淀粉酶升高(8%)。严重、与停药相关或与死亡相关的TEAE分别发生在31%、24%(16%与Dato-DXd相关)和6%的患者中。17%的患者因 TEAE与Dato-DXd相关而出现剂量减少。12例患者发生药物相关性间质性肺病(10%;9例为1-2级,3例为3级)。
一线Dato-DXd + pembro二联疗法的ORR为60% (95% CI, 36%-81%;12[2未经证实]/20),一线Dato-DXd + pembro + Pt-CT三联疗法的ORR为55% (95% CI, 39%-70%;23[5未经证实]/42)。所有治疗线数患者中,二联疗法ORR为38% (95% CI, 25%-54%;18[2未经证实]/47)和三联疗法ORR为47% (95% CI, 34%-60%; 28[5未经证 实]/60 )。在这两个亚群中,疾病控制率为85%,中位缓解持续时间未达到。在所有3个PD-L1表达水平亚组中均观察到应答。虽然未成熟,但二联和三联治疗的中位无进 展生存期(95% CI)分别为10.8(8.3-15.2)和7.8个月(5.5-NE)。
结论:
Dato-DXd + pembroo±Pt-CT显示出可耐受的安全性,在这个首个也是最大的ADC +免疫治疗±Pt-CT的aNSCLC患者数据集中具有显著的1L活性。
临床试验信息:NCT04526691。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)